上文中(新食品原料与食品添加剂新品种申报异同点(上)——相同点),瑞旭集团汇总了新食品原料和食品添加剂新品种申报的相同点,本文将进一步阐述两者在申报时的差异和区别。
定义和范围
|
新食品原料 |
食品添加剂新品种 |
|
|
定 义 和 范 围 |
是指在我国无传统食用习惯的以下物品: (一)动物、植物和微生物; (二)从动物、植物和微生物中分离的成分; (三)原有结构发生改变的食品成分; (四)其他新研制的食品原料。 |
食品添加剂新品种是指: (一)未列入食品安全国家标准(GB2760、GB14880)的食品添加剂品种; (二)未列入卫健委公告允许使用的食品添加剂品种; (三)扩大使用范围或者用量的食品添加剂品种。 |
|
其 他要求 |
新食品原料应当具有食品原料的特性,符合应当有的营养要求,且无毒、无害,对人体健康不造成任何急性、亚急性、慢性或者其他潜在性危害。 |
食品添加剂应当在技术上确有必要且经过风险评估证明安全可靠。 |
申报不同点
- 不同点1——申报资料
根据《新食品原料卫生行政许可申报与受理规定》以及《食品添加剂新品种申报与受理规定》的要求,其申报时所需的申报资料如下表:
|
新食品原料 |
食品添加剂新品种 |
|
|
申报资料 |
1)申请表; 2)新食品原料研制报告; 3)安全性评估报告; 4)生产工艺; 5)执行的相关标准(包括安全要求、质量规格、检验方法等); 6)标签及说明书; 7)国内外研究利用情况和相关安全性评估资料; 8)申报委托书(委托代理申报时提供); 9)有助于评审的其他资料; |
1)申请表; 2)通用名称、功能分类,用量和使用范围; 3)证明技术上确有必要和使用效果的资料或者文件; 4)质量规格要求、生产使用工艺和检验方法,食品中该添加剂的检验方法或者相关情况说明; 5)安全性评估资料,包括生产原料或者来源、化学结构和物理特性、生产工艺、毒理学安全性评价资料或者检验报告、质量规格检验报告; 6)标签或说明书样稿; 7)其他国家(地区)、国际组织允许生产和使用等有助于安全性评估的资料; |
注:进口的新食品原料/食品添加剂新品种还需额外提交两份证明文件。
重点区别分析
新食品原料须具备食品原料属性,注重原料的营养性和安全性,不在食品中起到工艺作用;而食品添加剂新品种则在某(几)类食品中起到改善食品品质和加工工艺的作用(例如:甜味剂、防腐剂、着色剂、稳定性、食品用香料等),有明确的加工用途。因此,新食品原料和食品添加剂新品种在申报时,除了共性的毒理安全性评估资料外,两者在申报所需资料的侧重点上存在明显的差异。
新食品原料强调原料研制报告,而食品添加剂新品种重在强调物质技术上确有必要和使用效果的资料。两者所需的详细资料要求如下:
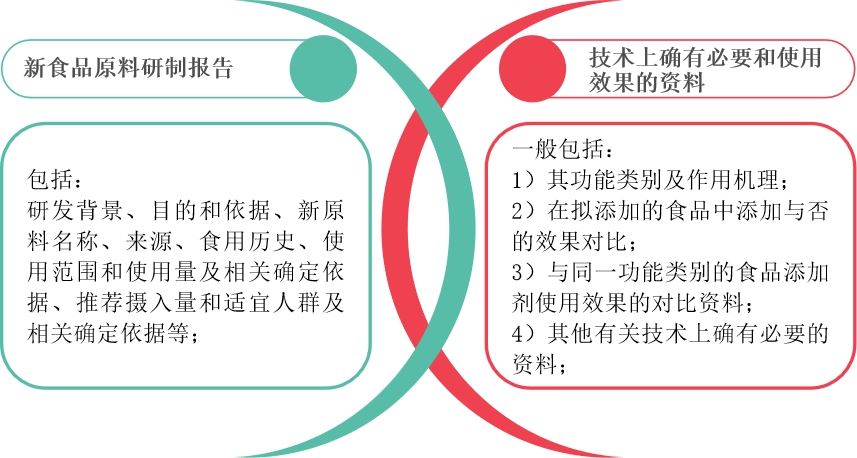
- 不同点2——试验要求

新食品原料和食品添加剂新品种申报所需的试验要求虽然不同,但又共通之处。
首先,新食品原料需要提供原料的 成分分析报告 (主要成分和可能的有害成分的检测结果及检测方法)和 卫生学检验报告 (3批有代表性样品的污染物和微生物的检测结果及方法)。而食品添加剂新品种要求提供添加剂自身 质量规格检验报告 (应当按照申报资料的质量规格要求和检验方法,对3个批次产品进行检验的检验结果报告)。这些试验要求是根据所申报产品的归属特性而提出的,是对申报物质“验明正身”的依据和凭证。
毒理试验的区别
1)新食品原料的毒理试验应根据原料在国内外的食用习惯来判定。详细的判断依据详见如下表格:
|
种类/ 试验 |
国内外均无传统食用习惯的(不包括微生物类) |
仅在国外个别国家或国内局部地区有食用习惯的(不包 括微生物类) |
已在多个国家批准广泛使用的(不包括微生物类) |
国内外均无食用习惯的微生 物 |
仅在国外个别国家或国内局部地区有食用习惯的微生物类 |
已在多个国家批准食用的微生 物类 |
|
急性经口毒性试验 |
是 |
是 |
是 |
- |
- |
- |
|
三项遗传毒性试验 |
是 |
是 |
是 |
是 |
是 |
- |
|
90天经口毒性试验 |
是 |
是 |
- |
是 |
是 |
- |
|
28天经口毒性试验 |
- |
- |
是 |
- |
- |
- |
|
致畸试验和 生殖毒性试验 |
是 |
是* |
- |
是 |
- |
- |
|
慢性毒性和致癌试验 |
是 |
- |
- |
- |
- |
- |
|
代谢试验 |
是 |
- |
- |
- |
- |
- |
|
急性经口毒性试验或致病性试验 |
- |
- |
- |
是 |
是 |
是 |
|
二项遗传毒性试验 |
- |
- |
- |
- |
- |
是 |
注:生殖毒性试验一般不需要。
2)食品添加剂新品种,按照GB 15193.1-2016可分为香料、酶制剂和其他食品添加剂来划分 ,各种类所需的试验汇总如下:
|
种类 |
判断分类 |
所需试验 |
|
香料 |
1)WHO已批准建议使用或已制定日容许摄入量,以及FEMA、COE、IOFI四个国际组织中的两个或以上批准 |
- |
|
2)资料不全或只有一个国际组织批准 |
急性经口毒性试验、一项遗传毒性试验 |
|
|
3)尚无资料可查,国际组织未允许使用 |
急性经口毒性试验、三项遗传毒性试验、28天经口毒性试验 |
|
|
4)用动、植物可食部分提前的单一高纯度天然香料,其化学结构及有关资料未显示不安全性 |
- |
|
|
酶制剂 |
1)具有长期安全使用历史的传统动植物可食部分生产的,WHO已公布或多个国家批准使用的 |
- |
|
2)对于其他来源,凡属毒理资料完整,WHO已公布或多个国家批准使用,质量规格跟国际质量标准一致 |
急性经口毒性试验、三项遗传毒性试验 (若质量规格标准不一致,应增加28天经口毒性试验) |
|
|
3)对于其他来源,凡属新品种的 |
急性经口毒性试验、三项遗传毒性试验、90天经口毒性试验、致畸试验 |
|
|
4)对于其他来源,凡属一个国家批准使用,WHO未公布日容许摄入量或资料不完整的 |
急性经口毒性试验、三项遗传毒性试验、28天经口毒性试验 |
|
|
其他添加剂(包括营养强化剂) |
1)毒理资料完整,WHO已公布或多个国家批准使用,质量规格跟国际质量标准一致 |
急性经口毒性试验、三项遗传毒性试验 (若质量规格标准不一致,应增加28天经口毒性试验) |
|
2)凡属一个国家批准,WHO未公布日容许摄入量或资料不完整的 |
急性经口毒性试验、三项遗传毒性试验、28天经口毒性试验、致畸试验 |
|
|
3)对于由动、植物或微生物提取的单一组分、高纯度的食品添加剂,凡属新品种 |
急性经口毒性试验、三项遗传毒性试验、90天经口毒性试验、致畸试验 |
|
|
4)凡属国外有一个国际组织或国家批准使用的 |
急性经口毒性试验、三项遗传毒性试验、28天经口毒性试验 |
- 不同点3——“预评估”(即安全性评估意见)
相比于食品添加剂新品种的申报卷宗,新食品原料还需要一份由有资质的风险评估技术机构出具的 安全性评估意见 ,根据《新食品原料卫生行政许可申报与受理规定》,此评估意见需要按照危害因子识别、危害特征描述、暴露评估、危险性特征描述的原则和方法进行。
这是新食品原料“专有”的一份资料, 一般3至6个月完成 ,需要出具评估意见单位在现有材料基础上,对原料物质做出一个相对全面的评估分析。相当于企业在向卫健委递交申报卷宗前,由相关机构对申报物质及材料做了一次“预评估”。
- 不同点4——审查结论
“三新”食品的审查结论通常有三种:建议批准(以“三新食品”公告形式发布)、建议不批准(发放不予行政许可决定书)和延期再审(企业可根据审查意见补充相关资料内容),而新食品原料的审查结论中还包含了一种独有的审查结论形式——终止审查。
目前,从终止审查产品的结论可以看出,除了实质等同的情况外,还包括作为普通食品管理,或作为地方特色食品管理,以及其他特殊的情况。因此,对于新食品原料申报企业来说,拿到终止审查中的“实质等同”、作为“普通食品管理”和作为“地方特色食品管理”等结果也算是一种“候补”获批途径。企业可根据该产品的审查结论,开展相关的生产/进口或者其他不悖于审查结论的事宜。
具体对于终止审查的介绍和分析,详见瑞旭集团以往文章:一文了解新食品原料的“终止审查”。
结语
本文对新食品原料和食品添加剂新品种的申报差异和区别进行逐一的分析和对比。企业在开展物质行政许可申报工作时,除了充分考虑物质的实际使用外,还应结合原料和添加剂新品种的申报资料要求来综合进行。若对物质的使用判别或申报过程有任何问题,可随时与瑞旭集团联系。
相关推荐:
UC的服务:
