各省、自治区、直辖市及计划单列市、新疆生产建设兵团工业和信息化主管部门、药品监督管理部门:
根据《关于组织开展生物医用材料创新任务揭榜挂帅(第一批)工作的通知》(工信厅联原函〔2022〕325号),经各地推荐、综合评审和网上公示,确定了生物医用材料创新任务揭榜挂帅(第一批)入围揭榜单位名单,现予以公布。有关事项通知如下:
一、请入围揭榜单位按照申报材料提出的攻关内容抓紧推进,确保揭榜任务按期保质完成。工业和信息化部会同国家药品监督管理局将不定期抽查,依托国家产融合作平台为入围项目提供投融资对接服务,并优先提供审评相关的技术咨询服务。
二、请各地工业和信息化主管部门会同药品监督管理部门加强对入围揭榜单位和项目的跟踪和服务,结合区域产业优势和临床资源,加大对入围揭榜单位和项目的支持,优先配置项目用地、用能、排污等指标资源,出台鼓励应用推广的配套政策。
三、入围揭榜单位完成攻关任务后(原则上名单公布之日起3年内),工业和信息化部、国家药品监督管理局将委托相关专业机构开展测评,择优确定揭榜优胜单位(每个揭榜产品原则上不超过2家)。鼓励揭榜项目的相关材料以医疗器械主文档形式进行登记,并通过新材料首批次应用保险补偿等政策支持应用推广。
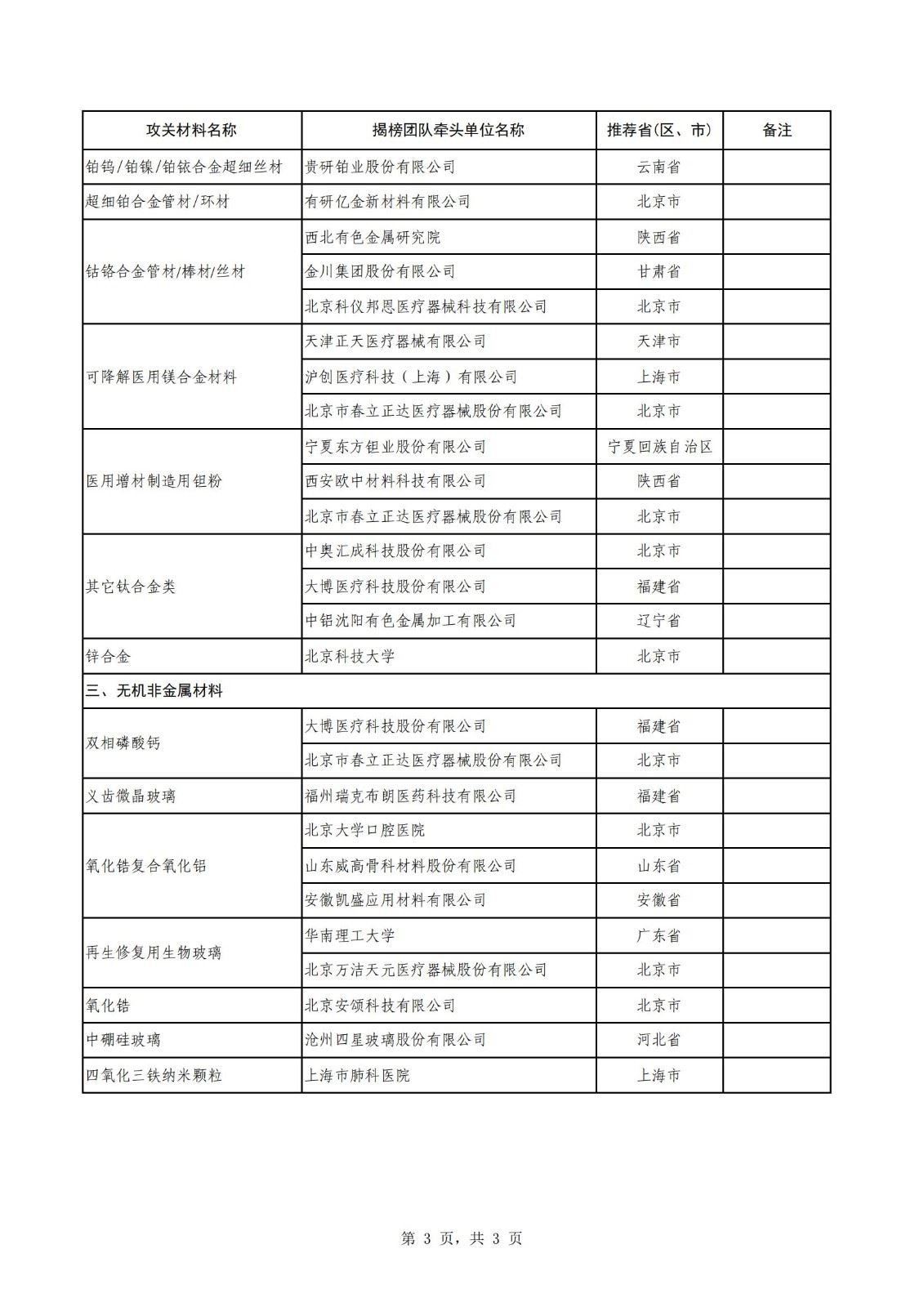
附件:生物医用材料创新任务揭榜挂帅(第一批)入围揭榜单位名单
工业和信息化部办公厅
国家药品监督管理局综合和规划财务司
2023年9月14日
对
于医疗器械原材料生产企业,出于技术保密的需求,
难以将原材料相关研究信息提供给下游医疗器械生产商,为平衡技术保密与终端器械生产企业审评审批,医疗器械原材料生产企业可依据相关法规要求进行医疗器械主文档登记事项。
登记的主文档主要为医疗器械原材料
的研究资料
,如工艺验证、化学表征、
生
物学
特性
、临床研究等技术资
料
。
《关于公开征求医疗器械主文档登记事项相关
文件
意见的通知》
《关于医疗器械主文
档登记事
项公告》(以下简称《公告》)
点击下方新闻,了解更多关于医疗器械主文档登记信息。
生物医用材料创新任务揭榜挂帅(第一批)入围揭榜单位名单


扫描下方的二维码订阅“
CIRS医械合规动态
”!实时传递最新医疗器械监管法规动态,分享医疗器械注册成功经验及经典案例跟踪医疗器械最新产品安全与法规监管动态,获得最新一手资讯。

① 凡本网注明"稿件来源:“杭州瑞旭科技集团有限公司"的所有文字、图片和音视频稿件,版权均属杭州瑞旭科技集团有限公司所有,任何媒体、网站或个人未经本网协议授权不得转载、链接、转贴或以其他方式复制发表。已经本网协议授权的媒体、网站,在下载使用时必须注明"稿件来源:杭州瑞旭科技集团有限公司",违者本网将依法追究责任。
② 本网未注明"稿件来源:杭州瑞旭科技集团有限公司 "的文/图等稿件均为转载稿,本网转载出于传递更多信息之目的,并不意味着赞同其观点或证实其内容的真实性。如其他媒体、网站或个人从本网下载使用,必须保留本网注明的"稿件来源",并自负版权等法律责任。如擅自篡改为"稿件来源:杭州瑞旭科技集团有限公司",本网将依法追究责任。如对稿件内容有疑议,请及时与UC联系。
③ 如本网转载稿涉及版权等问题,请作者在两周内速来电或来函与杭州瑞旭科技集团有限公司联系。




