人类使用化妆品的历史源远流长,原始社会就已经出现了简单天然的护肤方式。原始部落在祭祀活动中会把动物油脂涂抹在皮肤上,使自己的肤色看起来健康而有光泽,从古至今,人们追逐美丽的脚步从未停止过,化妆品现如今已成为人们生活中最为常见的消费品之一。2019年全球化妆品市场规模达到4996亿美元,其中我国约占据全球化妆品市场份额的14%,仅次于美国,排名第二。2019年,我国化妆品行业市场规模高达4777亿元,同比增长13.84%,增速高于全球。但从人均化妆品消费水平来看,中国人均消费仍落后于发达国家,随着经济发展、人民消费水平的持续提升以及消费意识的转变,化妆品行业发展空间更为广阔,化妆品生产在经济发展中属于朝阳产业。
与药品不同,化妆品主要发挥美化、点缀生活的作用,因此安全性是其最基本的特性,然后才是产品的功效。企业研发化妆品应将产品安全性置于首要位置。我国现行法规将化妆品分为特殊化妆品和普通化妆品,其中特殊化妆品包括染发、烫发、祛斑美白、防晒和防脱发化妆品以及宣称新功效的化妆品。相对于普通化妆品(例如宣称具有清洁、滋润、保湿等功效的化妆品),特殊化妆品因具有较高的风险,依照我国按风险程度实行分类管理的原则,对其实行注册管理。我国化妆品安全评价部门在产品安全性审查过程中发挥着重要的技术支撑作用,化妆品安全技术评价是我国化妆品监管体系的重要环节,其中特殊化妆品的安全评价又是评价体系的重要组成部分。
目前尚无对特殊化妆品安全评价中所发现问题进行系统分析和梳理的相关报道。作者结合开展化妆品安全技术评价的工作经历,归纳并整理了影响产品安全性的若干问题,并结合相关法规、部门规章和规范性文件,对具体案例开展分析,为化妆品产品研发、相关监管部门、技术机构评估产品安全性提供借鉴。
1、化妆品安全技术评价相关法规、部门规章和规范性文件
1.1 化妆品监管法规
《化妆品卫生监督条例》的效力至2020年12月31日止,2019年国务院曾对其进行了局部修正。自2021年1月1日起施行的化妆品监管法规为《化妆品监督管理条例》(下称“《条例》”),2020年6月16日由李克强总理签署并于2020年6月29日由国务院正式发布。
《条例》中规定,化妆品是指以涂擦、喷洒或者其他类似方法,施用于皮肤、毛发、指甲、口唇等人体表面,以清洁、保护、美化、修饰为目的的日用化学工业产品。该定义从使用方法、使用部位、使用目的和产品属性四个方面对化妆品进行了界定。
1.2 化妆品监管部门规章
化妆品安全技术评价的参考文件依据除监管法规外,还包括了一系列部门规章,如和《化妆品卫生监督条例》配套的《化妆品卫生监督条例实施细则》、《化妆品标识管理规定》等。随着新《条例》的实施,配套出台的部门规章有《化妆品注册备案管理办法》、《化妆品生产经营监督管理办法》以及《牙膏监督管理办法》。目前《化妆品注册备案管理办法》和《化妆品生产经营监督管理办法》已经由国家市场监督管理总局正式发布,前者自2021年5月1日起施行,后者自2022年1月1日起施行。《牙膏监督管理办法》已公开征求了意见。
1.3 化妆品监管规范性文件
在《化妆品卫生监督条例》框架下,安全技术评价参考的规范性文件有2009年发布的《化妆品行政许可申报受理规定》,此为申报资料准备和受理工作的重要依据;2010年发布的《化妆品技术审评要点》和《化妆品技术审评指南》、《化妆品命名规定》及《化妆品命名指南》、《国际化妆品原料标准中文名称目录》和《化妆品中可能存在的安全性风险物质风险评估指南》等系列文件,为安全技术评价工作的重要依据。2015年发布了《化妆品安全技术规范》(下称“《规范》”),2021年发布了《已使用化妆品原料目录》,前者是进行安全性评价的重要技术参考,后者是判定配方中是否使用了化妆品新原料的重要依据;2019年发布了《化妆品注册和备案检验工作规范》,是设定化妆品注册检验和备案检验项目、评价检验报告规范性的重要参考。
此外国家局发布的通知、通告、公告及其解读,以及国家局发布的《化妆品监督管理常见问题解答》,也是安全技术评价所依据的参考。国家标准(如GB5296.3—2008消费品使用说明化妆品通用标签)、推荐性国家标准和行业标准,也作为参考文件使用。
配合新《条例》的实施,一系列配套文件已经出台,如《化妆品标签管理办法》、《化妆品注册备案资料管理规定》、《化妆品新原料注册备案资料管理规定》、《化妆品安全评估技术导则》等,这些文件会替代原《化妆品卫生监督条例》框架下的部分文件。
2、特殊化妆品技术评价涉及安全性的问题及分析
从特殊化妆品安全技术评价工作实际发现,涉及产品安全性的问题主要包括以下几种情况:产品不符合化妆品定义范畴、产品中使用了未经我国化妆品监管部门批准的新原料、产品配方不符合《化妆品安全技术规范》要求以及申报资料前后不一致等。
2.1 产品不符合化妆品定义范畴
《化妆品卫生监督条例》第十条规定特殊用途化妆品是指:用于育发、染发、烫发、脱毛、美乳、健美、除臭、祛斑、防晒的化妆品。其中脱毛类化妆品在配套的《化妆品卫生监督条例实施细则》第五十六条规定:脱毛化妆品为具有减少、消除体毛作用的化妆品。某进口蜜蜡申报脱毛类化妆品,原包装有“脸部蜜蜡”字样,宣称“摆脱脸部细小毛发带来的烦恼”,并在其中文标签的使用方法中宣称用于面部脱毛。这和脱毛类化妆品定义不符合,超出了脱毛类化妆品范畴。因为按照《化妆品卫生监督条例》框架下的检验要求,脱毛类产品需要开展汞、铅、砷、镉等理化检验项目,毒理学试验仅需开展皮肤变态反应试验,物理脱毛类产品需要进行微生物检验,上述检测无法保证产品应用于“眉毛周围、唇周下巴、面颊”等部位的安全性。需要说明的是,新《条例》及其配套文件《化妆品分类规则和分类目录》中,将脱毛类化妆品列为普通化妆品;在《化妆品分类规则和分类目录》功效宣称分类目录中,“脱毛”类功效宣称的释义和说明中,将“脱毛”解释为“用于减少或除去体毛”,在“化妆品作用部位分类目录”中,作用部位体毛“不包括头面部毛发”。因此在新《条例》框架下,脱体毛类产品实行备案制,脱面部毛发产品按照宣称新功效的特殊化妆品来监管。
某进口面膜产品,在原包装中宣称“对准面部穴位贴敷,轻轻按压,可改善循环,改善浮肿”。使用方法为“穴位贴敷”,与《条例》中“涂擦、喷洒或者其他类似方法”的使用方法不符,使用目的为“改善循环”、“改善浮肿”,与“清洁、保护、美化、修饰”的使用目的不符,超出了化妆品的定义,无法判定产品安全性。
2.2 产品中使用了未经我国化妆品监管部门批准的新原料
原国家食品药品监督管理总局在2015年发布了《已使用化妆品原料名称目录》,此目录是对在我国境内生产、销售的化妆品所使用原料的客观收录,共收录了8783种化妆品原料。2021年国家药品监督管理局发布了《已使用化妆品原料目录》,收录了8900余种原料,自2021年5月1日起施行。未收录于该目录中的原料,按照新原料管理。需要注意的是,化妆品生产企业在选用目录中所列原料时,应当符合国家有关法规、标准、规范的相关要求,并对原料进行安全性风险评估。
《化妆品监督管理条例》规定,在我国境内首次使用于化妆品的天然或者人工原料为化妆品新原料,化妆品新原料经国务院药品监督管理部门注册或备案后方可使用。我国化妆品新原料的注册或备案需要经过严格的安全评价,提供能够证明原料安全性的毒理学评价资料和风险评估资料,有一系列申报材料支撑,并且要经过严格的注册或备案程序。在《化妆品新原料注册备案资料管理规定》中对新原料的注册备案工作有了明确的要求。产品配方中使用未经监管部门注册或备案的新原料显然是不允许的。
在安全技术评价工作中发现,注册人将收录在《已使用化妆品原料目录》中原料的发酵产物等同于该原料,导致在配方中使用新原料的问题发生。发酵技术是利用微生物细胞或细胞内的酶催化反应体系对原料中的成分进行结构修饰和改造,并运用技术手段控制过程,从而实现大规模生产发酵产品的技术。原料经过微生物发酵后,结构会发生变化,且往往会形成与化学合成法所不同的特殊结构,因此原料经过发酵的产物不能等同于发酵前的原料。例如,申报配方中填写的原料为“冬虫夏草菌丝体经发酵、过滤、烘干、碾磨而得到的浅棕色粉末”。冬虫夏草在中国药典一部中收载,为麦角菌科真菌冬虫夏草菌Cordycepssinensis(BerK.)Sacc.寄生在蝙蝠蛾科昆虫幼虫上的子座和幼虫尸体的干燥复合体,为传统中药。冬虫夏草(CORDYCEPSSINENSIS)提取物收录在《已使用化妆品原料目录》中,但配方中实际使用的是冬虫夏草经发酵工艺后的加工品,其发酵产物未收录于《已使用化妆品原料目录》中,属于未经化妆品监督管理部门批准的新原料。
安全技术评价工作中还发现,对配方中寡肽类原料的使用,注册人也存在误用新原料的情况。例如寡肽-1,容易和植物合成多肽、重组肽以及人寡肽-1(即人表皮生长因子,hEGF)发生混淆。在欧盟委员会官方化妆品成分数据库中,寡肽-1为甘氨酸、组氨酸和赖氨酸的寡聚物(Glycine,oligomerwithhistidineandlysine);《国际化妆品原料字典》将寡肽-1描述为由甘氨酸、组氨酸和赖氨酸组成的合成肽。在评价工作中发现,“寡肽-1”原料的质量规格显示,配方中使用的“寡肽-1”为59个氨基酸组成的植物合成多肽,或者来源于大肠杆菌的由18种氨基酸组成的重组肽,这些不符合寡肽-1的氨基酸组成。人寡肽-1是一种广泛存在于人类皮肤细胞的小分子蛋白质,由53个氨基酸组成,可以促进多种细胞生长,包括促进人干细胞生长,如可促进受损表皮的修复和再生,用于皮肤科术后促进伤口愈合等。国家药品监督管理局《化妆品监督管理常见问题解答(一)》中提到,寡肽-1一般作为皮肤调理剂使用。人寡肽-1一般在医学领域使用较多,由于分子量较大,在正常皮肤屏障条件下较难被吸收,一旦皮肤屏障功能不全,可能会引发其他潜在安全性问题。基于有效性及安全性方面的考虑,人寡肽-1不得作为化妆品原料使用。因此显示使用寡肽-1的化妆品配方,应根据原料质量规格判断实际使用的原料。
2.3 产品配方不符合《化妆品安全技术规范》要求
我国《化妆品安全技术规范》充分借鉴了美国、欧盟等国家和地区化妆品安全性评价的管理法规,并综合了我国化妆品风险评估及化妆品监管的重要经验,重点关注对风险物质的管理。《规范》要求化妆品配方不得使用《规范》表中所列的禁用组分,若技术上无法避免禁用物质作为杂质带入化妆品时,国家有限量规定的应符合其规定;未规定限量的,应进行安全性风险评估,确保在正常、合理及可预见的适用条件下不得对人体健康产生危害。
当使用限用组分表中所列物质时,《规范》要求化妆品配方应符合限用组分表中适用及(或)使用范围(如产品类型、作用等)、使用时的最大允许浓度以及其他限制和要求。
另外,《规范》的准用组分表列出了配方中准用的防腐剂、防晒剂、着色剂和染发剂,这四类原料相对风险较高,因此监管部门制定了准用清单,并对原料的纯度、规格,使用范围,使用的最大允许浓度等作出了明确规定。在产品安全技术评价中发现配方中限用组分、准用组分的使用不符合《规范》要求的情况。
2.3.1 配方中原料有形成亚硝胺风险
某产品配方中同时使用了“2-溴-2-硝基丙烷1,3-二醇”和“三乙醇胺”。2-溴-2-硝基丙烷-1,3-二醇收录于《规范》准用防腐剂列表中,使用范围和限制条件项下注明“避免形成亚硝胺”;三乙醇胺属于《规范》限用组分表中“三链烷胺、三链烷醇胺及它们的盐类”项下的三链烷醇胺,要求不和亚硝基化体系一起使用,避免形成亚硝胺,最低纯度99%,原料中仲链烷胺最大含量0.5%,产品中亚硝胺最大含量50g/kg,存放于无亚硝酸盐的容器内。即三乙醇胺应当满足几个方面的要求:1)使用条件限制其不和亚硝基化体系一起使用,避免形成亚硝胺;2)原料的纯度、以及原料中无法避免带入禁用物质仲链烷胺的最大含量限制;3)使用该原料的终产品中亚硝胺的最大允许限量;4)原料的存放条件要求其存放于无亚硝酸盐的容器中。
亚硝胺是包含了R2(R1)N-N=O结构的一类化合物,在自然界中,亚硝酸盐极易与胺类发生反应生成亚硝胺。亚硝胺的毒性主要体现在急性毒性和致癌性两个方面,可引起急性肝损伤,在体内经代谢酶活化后产生广谱致癌性。从上述分析可以看出,2-溴-2-硝基丙烷-1,3-二醇和三乙醇胺两种原料同时使用,有形成亚硝胺风险,不符合《规范》要求,可能影响产品安全性。
2.3.2 防腐剂使用超出了限制条件
化妆品中含有大量水和营养物质,为防止微生物生长繁殖,导致产品腐败变质,配方中通常会添加防腐剂。碘丙炔醇丁基氨甲酸酯(IPBC)是有效的防腐剂,能抑制霉菌、酵母菌等真菌生长,常与抑制细菌生长的防腐剂搭配使用,构成防腐体系,但IPBC有可能导致接触性皮炎的报道,吸入后会引起神经毒性、肝脏毒性,研究表明IPBC含量为0.2%时能够满足人体安全要求。在我国《化妆品安全技术规范》中对其使用有一系列限制:要求禁用于三岁以下儿童,禁用于唇部产品,使用于驻留类产品时禁用于体霜体乳等;对其最大允许使用浓度的要求为,淋洗类产品0.02%,驻留类产品0.01%,除臭产品和抑汗产品0.0075%。
某产品配方中含有IPBC,使用方法为“取适量本品均匀涂抹于可能暴露在阳光下的皮肤上”。根据该产品的使用方法,作为驻留类产品其可能大量用于身体表面,因此,具有一定的安全隐患。
2.3.3 着色剂使用不符合《规范》要求
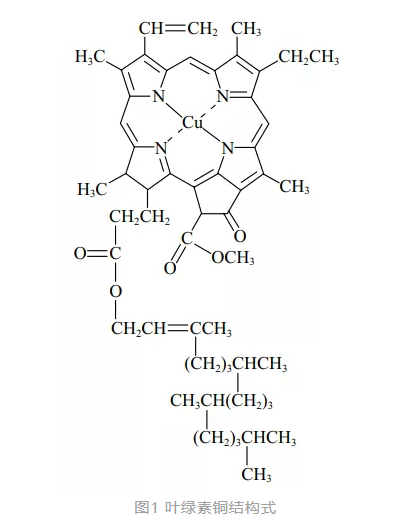
某染发产品申报配方含有叶绿素铜(COPPERCHLOROPHYLL),使用目的为“着色剂”。而《规范》准用着色剂列表中收录了着色剂索引号为CI75810的物质,其着色剂索引通用中文名为天然绿3(叶绿酸-铜络合物)。在欧盟委员会化妆品成分数据库中,着色剂索引号CI75810对应的物质INCI名称为CHLOROPHYLLIN-COPPERCOMPLEX(CAS号:11006-34-1),作为着色剂使用;叶绿酸-铜络合物(CHLOROPHYLLIN-COPPERCOMPLEX)是叶绿素(CHLOROPHYLL)通过碱水解,取代了甲基等基团,并以铜取代镁来制得的。经过水解过程,去除疏水性侧链,增加了水溶性。
叶绿素铜(COPPERCHLOROPHYLL)也是一种着色剂,其结构式如图1所示。叶绿酸-铜络合物和叶绿素铜不是同一种物质,叶绿素铜未收载于《化妆品安全技术规范》着色剂列表中,其作为着色剂使用的安全性需要进一步论证。
2.4 申报资料前后不一致的情况
申报资料前后不一致,影响技术判断的情况具体包括:产品申请注册时经检验机构确认的配方发生改变;配方以外的资料与申报配方不符;在补充资料阶段,提交的产品的生产工艺和首次申报时不一致;已作出建议不批准结论的产品,复核时申报单位自行改变产品原申报资料。下面结合具体案例就上述问题开展分析。
2.4.1 检验机构确认的配方发生改变
在产品申报阶段,注册人将产品送到化妆品注册和备案检验检测机构,经过检验检测机构盖章确认的产品配方一般情况下不能更改,如果的确在配方填报出现了文字性的错误,需要作出修改的,需要注册人提交说明材料,以备技术评价时参考判断。
某产品配方中申报了“浮游生物提取物”,按照我国《已使用化妆品原料目录》,“浮游生物提取物”是一类原料,应当说明所包含的具体原料。该产品与检验机构盖章确认的配方相比,注册人将“浮游生物提取物”所指的具体原料进行了修改,并提供了藻类在分类学上的相关资料,以证明修改前后的所指的具体原料仅为文字表述的不同,配方并未发生实质性改变。经查,提供的说明性文件不能够支持注册人的说法,修改前后所指的两种藻类拉丁学名不同,不是同一原料。
2.4.2 配方以外的资料与申报配方不符
配方以外的资料显示原料种类或含量与申报配方不符,此类情况比较常见,往往是注册人疏忽导致。例如某产品在生产工艺中,列出了工艺的各个分相以及各分相对应的原料序号,但是对照配方发现,配方中缺少工艺中列出的某些原料;此外标签中标注的成分在配方中未见也是常见的和配方不符的情况,根据《GB5296.3—2008消费品使用说明化妆品通用标签》的要求,在化妆品销售包装的可视面上应真实地标注化妆品全部成分的名称。《化妆品技术审评指南》中也明确要求“产品包装(含产品标签、产品说明书)所标注的原料名称,涉及含量应与产品配方相符”。标签标示成分未在配方中出现的情形,依据《化妆品技术审评要点》,属于出具“建议不批准”评价结论的情形。
2.4.3 生产工艺前后不一致
此类情形通常和生产工艺不合理的问题同时出现。例如某祛斑类产品的配方中,抗坏血酸作为祛斑功效成分添加量达到22%,配方中其他原料包括丙二醇、聚乙二醇-8、甘油、丁二醇等,含量均低于抗坏血酸。抗坏血酸易溶于水、甲醇,溶解度会随着溶剂极性降低而下降,在三氯甲烷或乙醚中不溶。生产工艺为70℃搅拌溶解后冷却、灌装,终产品的感官指标描述为“微黄色透明液体”。
根据其生产工艺描述,技术评价时对在现有配方和工艺条件下能够制成“微黄色透明液体”提出质疑,要求进一步提供能制成本品的科学依据,以及抗坏血酸在丙二醇等溶剂中的溶解度等资料。注册人在后续补充资料中,申报工艺发生了明显变化,包括原料分相、加热温度、以及生产设备种类等,涉及了重要工艺参数的调整。需要指明的是,产品在申报注册时提交的工艺,应为经过小试、中试放大、实际生产等环节后,其合理性和可操作性已经确定的生产工艺,关键工艺参数应准确、清晰。
2.4.4 已作出建议不批准结论的产品,复核时申报单位自行改变产品原申报资料
根据上述法规、部门规章和规范性文件开展特殊化妆品技术评价时,技术结论分为3种,分别为:建议批准、补充资料延期再审和建议不批准。某产品被出具建议不批准意见之后,如果注册人对意见有异议,可以选择申请复核,复核阶段需要提交对结论有异议的理由和相关证明资料。技术评价对复核资料不予认可的,维持原“建议不批准”结论;认可相关资料,可以修改为建议批准结论或要求补充资料后,延期再审。
“2.3.2”中因防腐剂使用超出了限制条件的产品,在复核阶段注册人提出将“使用方法”修改为“涂抹于面部肌肤”,从而满足《规范》中“使用于驻留类产品时禁用于体霜体乳”的要求。此处需要说明的是,复核阶段仅对先前作出的不恰当结论予以更正,如果先前建议不批准结论无误,则对复核理由不予认可。同时一个产品在设计之初,就应根据配方明确具体使用方法、使用部位等,而非根据不批准意见做临时的调整,因此复核结论为不认可复核理由,维持原结论。
3、结语
1)我国现行法规按风险程度对化妆品实施分类管理,因特殊化妆品相对于普通化妆品具有较高的风险,其化妆品安全技术评价是化妆品监管中的重要组成部分。从技术评价工作实际出发,有针对性地对化妆品安全技术评价相关法规、常用的部门规章和规范性文件进行较为详细的介绍和解读,了解并熟悉其中内容,对于掌握评价尺度、实现科学评价大有裨益。
2)结合在第一线开展安全技术评价工作的体会,笔者对影响特殊化妆品安全性的问题进行了归纳和梳理,并进行了较为系统的分析,弥补了目前特殊化妆品安全评价常见问题相关报道的匮缺,并在结合相关法规、部门规章和规范性文件的基础上,对具体案例开展了分析,对于指导产品研发、资料编撰、安全评价具有实际参考意义。
3)根据笔者在文中的介绍和分析,化妆品安全技术评价中发现的主要问题,以影响产品安全性的问题为主,例如产品不符合化妆品定义范畴、产品中使用了未经我国化妆品监管部门批准的新原料、产品配方不符合《化妆品安全技术规范》要求,都将导致评价过程中无法进行安全性的判断,这也从技术评价角度反映出安全性是化妆品基本属性的特点;此外还有申报资料前后不一致,除了涉及影响安全性判定之外,还涉及了资料真实性的问题,因此,维护技术评价工作的严谨性和严肃性也是需要坚持的重要原则。
化妆品申请人、开展评价工作的技术人员应加强学习,既要注重资料中影响安全性问题的甄别,在资料编撰、资料技术评价中能够有的放矢,同时申请人更应当注重进一步提高申报资料的质量,对于不必要的错误应尽量避免,从而缩短产品申报的周期,更充分地发挥技术评价资源的作用。
4)在新的《化妆品监督管理条例》框架下,对化妆品注册人、备案人在质量管理体系、不良反应监测与评价等方面提出了更高的要求,注册人、备案人对产品的质量安全和功效宣称的主体责任更加突出,化妆品监管实现社会共治的理念更加凸显;同时原料风险作为产品风险的一个重要来源,对新原料的管理要求变化较大。例如化妆品新原料将实行3年监测期制度,同时在《条例》配套文件中,对化妆品新原料在安全性评价、安全监测及突发情况报告等方面,均提出了明确的资料要求;此外《条例》还强调了化妆品监督管理的信息化建设,对于监管信息共享、失信管理也将迈上一个新台阶。
相关推荐:
- 多种原料被禁用?专家带你全面解读儿童化妆品新规!
- 4个化妆品新原料成功备案 化妆品企业研发创新迎来新机
- 市场监管总局关于发布《医疗美容广告执法指南》的公告
- 化妆品注册备案信息服务平台使用常见问题解答
- 2021年至今,监管部门发布的化妆品检验检测机构不合格问题汇总
UC的服务:
