
摘要
背景:如果皮肤的屏障性能可以暂时和可逆性的降低,那么皮肤为肽的递送提供了各种益处和潜力。由于肽具有高分子量、亲水性(大多数情况)和结构中的可电离基团,因此其皮肤递送极具挑战性。除此之外,它们还易受皮肤中蛋白水解酶的影响。抗皱肽与其他肽一样,存在皮肤渗透性不足的问题,而其中大多数的肽必须深入皮肤才能发挥功效。尽管细胞研究表明了此类肽的有效性,但在不能充分渗透皮肤的情况下,此功效是无用的。抗皱肽的皮肤渗透性差引发了现今所进行的研究,即寻找化妆品消费者所希望的可行且无创的肽皮肤渗透的增强方法。
方法:本文全面综述了抗皱肽经皮肤渗透的可能性,以及迄今为止用于增加这些难溶性分子渗透性的化学、物理以及包封方法。结果:大多数抗皱肽不适合作为皮肤渗透的备选物质,并且使用增强方法对提高其渗透性至关重要。为此,迄今为止仅有一些增强渗透性的方法的已采用,包括用疏水基团或细胞穿膜肽进行的化学修饰、金属络合、化学促渗剂、电离子透入疗法、微针和纳米载体包封等方法。已发表的对抗皱肽肌肽、GHK肽、PKEK肽、GEKG肽、GQPR肽和KTTKS肽的皮肤渗透性的研究结果表明,这些肽的皮肤渗透性可以成功的被提高。结论:尽管大多数抗皱肽的皮肤渗透性不够高,且在合适的浓度下大多数抗皱肽可能无法达到其在皮肤中的靶点,但他们的渗透性可以通过各种增强方法达到治疗浓度。关键词:抗皱肽、美容肽、增强渗透性的方法、肽的皮肤递送、皮肤渗透性
01 引言
拥有健康年轻的皮肤是公认的年轻标志。因此,寻找适用且便利的方法来防止衰老是研究界一个突出且有吸引力的话题,其中使用含有肽的局部抗皱产品看起来很有前景。局部肽被分为四个主要类别;信号肽、酶抑制剂肽、神经递质-抑制剂肽和载体肽[1,2]。通常,信号肽通过刺激基质蛋白的产生起作用。酶抑制剂肽会降低或抑制参与皮肤衰老相关的酶的活性。对乙酰胆碱释放的抑制由神经递质-抑制剂肽所引起,载体肽运输主要的微量元素[2,3]。无论属于哪一类,肽都不适合作为输送到皮肤或穿过皮肤的候选物质。抗皱肽的分子量通常大于皮肤的理想分子量界限(即500Da)。它们分配系数(log P)的对数一般小于适合穿过皮肤的logP的范围(即1–3)。抗皱肽通常是生理PH值下的带电分子。此外,这些肽分子是皮肤中蛋白水解酶的底物。由于具有这样的特性,因此肽分子不能在合适的浓度下穿过皮肤[4]。尽管关于抗皱肽皮肤渗透性的文献很少,但是含有抗皱肽的抗皱产品越来越多地在化妆品市场上推出,且这些产品尚没有关注到皮肤渗透性是使抗皱肽产生成效的这一先决条件。
虽然衰老会影响皮肤所有的层,但真皮会发生显著的变性变化[5]。真皮是大多数抗皱肽的作用靶点。为了有效果,这类肽分子必须通过角质层(最重要的皮肤屏障)以及活性表皮,且不会被蛋白水解酶显著降解。然后,这些肽分子必须以合适的浓度到达真皮,以起到抗皱剂的作用。因此,对于大多数抗皱肽而言,穿过活性表皮的渗透是必需的[6]。根据文献,大多数肽具有抗皱特性[7,8],例如,棕榈酰五肽(Pal-KTTKS)可以增加成纤维细胞培养物中胶原蛋白的产生[9],但主要问题是局部应用Pal-KTTKS是否可以到达能真皮处的成纤维细胞。在抗皱肽领域进行的大多数研究都在关注功效而非皮肤渗透性。
以下研究是少数研究局部抗皱肽产品皮肤渗透性的研究。 乙酰基六肽-3是一种合成的神经递质-抑制肽,分子量为889Da,clog P值为-6.67。这种肉毒杆菌样肽在化妆品市场上以Argirelin®的品牌名称出售。使用无毛豚鼠(作为活性皮肤模型)和人(尸)体皮肤评估了来自商业O/W乳剂的乙酰基六肽-3的皮肤渗透。受体相为HEPES缓冲的Hank平衡盐溶液,供体相为含有10%乙酰基六肽-3的O/W乳剂。无论膜的类型如何,24小时后在真皮和受体相中均未检测到该肽。在两种类型膜的表皮中仅发现所用剂量的0.01%。角质层中保留肽的百分比不同,豚鼠和人(尸)体皮肤分别留有施加剂量的0.53%和0.22%。这种差异归因于啮齿动物的皮肤比人皮肤具有更高的渗透性[10]。乙酰基六肽-3必须靶向肌肉神经接点并影响面部表情的肌肉,但根据本研究的结果,其并无法到达真皮。 尽管对美容肽的皮肤渗透性进行的研究不多,但所进行的少数研究的结果指出,美容肽对皮肤渗透来说并非最佳备选物质。含有抗皱肽的产品并不便宜。然而,美容肽的皮肤渗透性差,在皮肤上施用后会导致大量的浪费;因此,这种产品的高成本强加给了消费者,却没有产生与之相配的肽的抗皱效果。为了克服渗透性差这一问题,研究人员一直试图使美容肽具有更高的渗透性,以便它们能够到达皮肤中的靶点。
本文全面综述了迄今为止为提高美容肽的皮肤渗透性而开展的不同化学、物理和包封方法的研究(图1)。表1中列出了本文中讨论的抗皱肽的序列、MW以及计算的logP 值(clog P)。
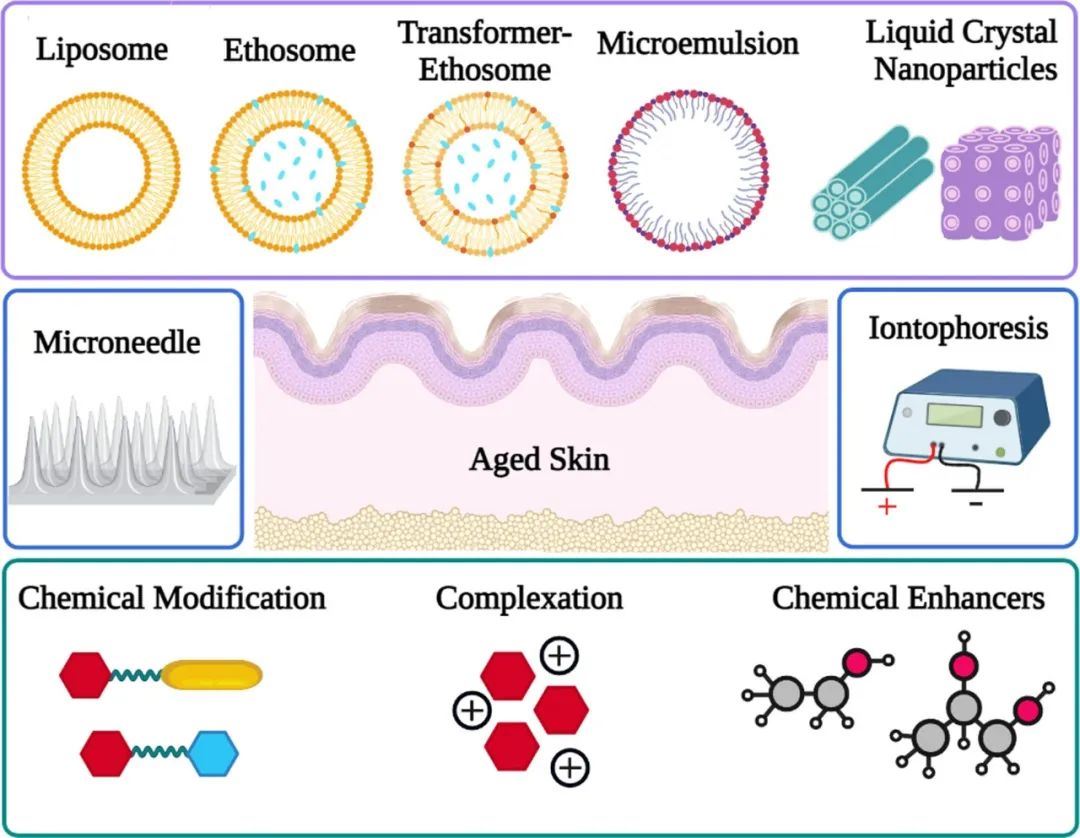
图1. 迄今为止用于增强抗皱肽的皮肤渗透性的化学、物理和包封方法的示意图(由BioRender.com创建)。
表1.亲本抗皱肽的序列、MW和计算的log P值(clog P)
|
肽 |
序列 |
MW |
clogP值* |
|
肌肽 |
β-丙氨酸-组氨酸 |
226.2 |
−2.17 |
|
促黑素抑制素 |
脯氨酸-亮氨酸-甘氨酸 |
284.3 |
−1.07 |
|
GHK |
甘氨酸-组胺-赖氨酸 |
340.4 |
−2.24 |
|
GEKG |
甘氨酸-谷氨酸-赖氨酸-甘氨酸 |
389.4 |
−2.58 |
|
GQPR |
甘氨酸-谷氨酰胺-脯氨酸-精氨酸 |
456.5 |
−3.21 |
|
VGVAPG |
缬氨酸-甘氨酸-缬氨酸-丙氨酸-脯氨酸-甘氨酸 |
498.6 |
−0.38 |
|
PKEK |
脯氨酸-赖氨酸-谷氨酸-赖氨酸 |
500.6 |
−2.53 |
|
KTTKS |
赖氨酸-苏氨酸-苏氨酸-赖氨酸-丝氨酸 |
563.6 |
−3.54 |
|
Pal-KTTKS |
棕榈酰-赖氨酸-苏氨酸-苏氨酸-赖氨酸-丝氨酸 |
802.0 |
3.72 |
|
乙酰六肽-3 |
乙酰-谷氨酸-谷氨酸 酸-蛋氨酸-谷氨酰胺-精氨酸-精氨酸-酰胺 |
889.0 |
−6.67 |
注:*本文中的所有clogP值均由ACD/ChemSketch免费软件计算得出[68]。
02 用于抗皱肽的化学增强方法
通过使用化学方法优化肽的皮肤递送,一种策略是通过化学修饰或络合并产生新的化合物来改变肽的结构,另一策略是通过化学促渗剂改变角质层的结构。如下所述,化学修饰、络合和化学促渗剂已被应用于增强抗皱肽的皮肤渗透。
2.1 化学修饰
通过共价键将化学基团结合到肽分子的天然结构中的过程被称为化学修饰。化学修饰不仅可以影响肽的皮肤渗透性,还可以使肽分子对蛋白水解酶有一定的抗性[4]。疏水基团(例如,脂肪酸、萜类)、具有生物学特性的基团(例如,抗坏血酸、硫辛酸)和细胞穿膜肽(例如,聚赖氨酸、聚精氨酸)均是已用于美容肽化学修饰的基团[8,11–14]。在美容肽领域中使用化学修饰的三个主要目的是增强皮肤的渗透性、生物功效和代谢稳定性。例如,用硫辛酸(一种可以调节黑素生成酶表达的含硫脂肪酸)对KTTKS进行化学修饰,将KTTKS转化为具有抗皱和抗黑色素生成特性的结合物[8]。另一例子是通过使用棕榈酸进行化学修饰来增强KTTKS的代谢稳定性。Choi等人的研究表明,与KTTKS相比,Pal-KTTKS在表皮和真皮皮肤提取物以及皮肤匀浆中的稳定性更高[15]。下文中,UC尝试将评述的范围限制于如下问题事项,如皮肤渗透性。
疏水基团疏水基团如脂氨基酸和具有不同链长(C2至C18)的脂肪酸已被用于增加治疗性多肽的渗透性[16–20]。脂氨基酸尚未应用于抗皱肽。除了脂肪酸之外,萜烯基团还用于抗皱肽的化学修饰[14]。疏水基团通过改变分配系数改变了肽向角质层细胞间脂质的趋向[4]。对于抗皱肽,可能会改变亲本肽的功能性基团,以获得更少的亲水性肽。本节还将讨论这一类型的结构性修饰。 五肽KTTKS(MW:563.6 Da,clog P:-3.54)被归类为能够促进细胞外基质生物合成的信号肽[7,21]。但是KTTKS的皮肤渗透性差是阻碍其抗皱性能的原因[15]。用疏水基团进行的化学修饰可能会影响这种高效肽的渗透性。KTTKS及其衍生物的化学结构如图2所示。
2000年,Sederma公司在化妆品市场推出了名为Matrixyl®的Pal-KTTKS。这种分子量为802Da、clog P值为3.72的肽缀合物是通过使用棕榈酸(16碳链)对KTTKS进行化学修饰而产生的。请注意,使用疏水基团的化学修饰同时增加了肽的疏水性和分子量。为了弄清疏水性、MW和疏水基团结构对肽的皮肤渗透性的影响,Mortazavi等人比较了棕榈酸(脂肪酸,线型,MW:256.4 Da,clog P: 7.15)、香茅酸(萜烯,线型,MW:170.25,clog P: 3.35)和紫苏酸(萜烯,环状,MW:166.22,clog P: 2.97)对KTTKS渗透性的影响。为此,合成了KTTKS、Pal-KTTKS、香茅酸-KTTKS (Cit-KTTKS)和紫苏酸-KTTKS(Per-KTTKS)(图2)。Pal-KTTKS、Cit-KTTKS和Per-KTTKS的clogP值分别为3.72、-0.08和-0.88。使用人表皮以及n-十六烷膜模型作为完全亲脂性屏障评估了肽的皮肤渗透。以多肽水溶液和10%乙醇溶液分别作为扩散池的供体相和受体相。
就膜模型而言,暴露24小时后,受体相未发现KTTKS和Per-KTTKS,而发现Pal-KTTKS和Cit-KTTKS,其预估渗透系数(kp)分别为17×10-4cm/h和2.9×10-4cm/h。结果还显示,20%的Pal-KTTKS应用剂量被n-十六烷膜模型以某种方式留存。该膜根据肽分子的分配系数对其进行筛选。就人表皮而言,暴露48小时后,受体相中未发现可检测含量的KTTKS和Pal-KTTKS。然而,与膜模型相比,Cit-KTTKS以更高的kp(7.3×10-4cm/h)透过人表皮,因此检测到2.6%的Cit-KTTKS应用剂量。
根据研究者的说法,鉴于棕榈酸是人角质层细胞间板层脂质基质的一种成分,并且由于棕榈酸和KTTKS都具有线性结构,因此有可能将Pal-KTTKS截留在角质层的板层结构中。Cit-KTTKS比Pal-KTTKS更小,疏水性也更低。它有一个不饱和的短碳链是分支的,这种结构使截留的可能性较低[14]。该研究表明,在化学修饰过程中,除了疏水性之外,还必须考虑其他性质,如分子量和化学基团结构。为了增加抗皱肽的渗透性,萜烯基团可能是脂肪酸的良好替代物[14]。
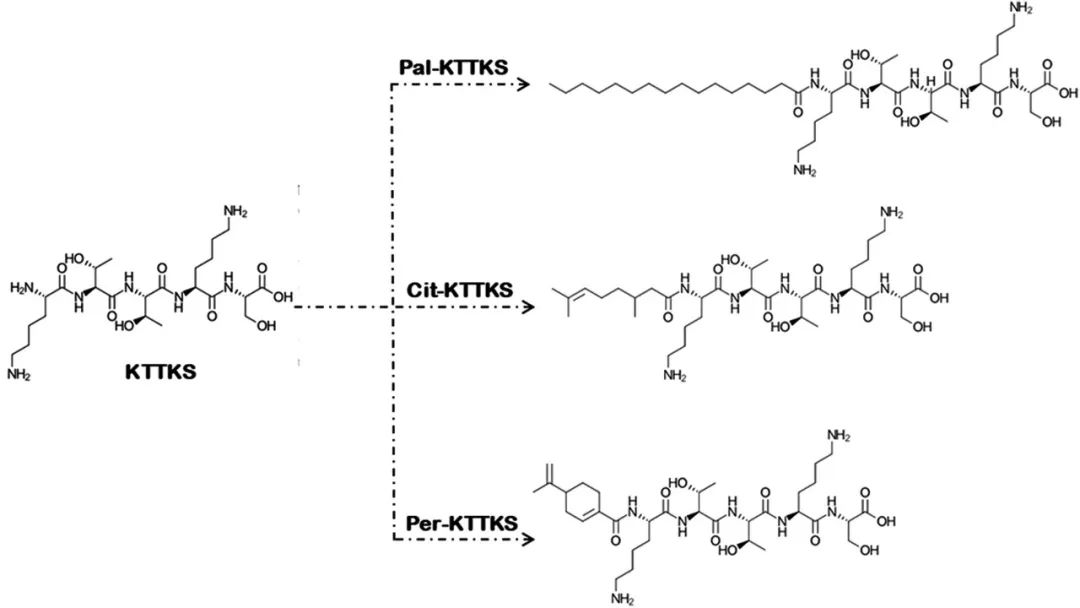
图2.带有疏水基团的KTTKS的化学修饰
为了减少两性离子型肽Argireline(Arg0)的形成,对其氨基酸侧链进行了化学修饰,并制备了三种类似物(Arg1、Arg2和Arg3)。Arg0由八个氨基酸残基(Ac-Glu-Glu-Met-Gln-Arg-Arg-NH2)组成(图3)。在所有类似物中,两个谷氨酸侧链的羧酸官能团均被酯化。对于Arg2,两个精氨酸氨基酸的侧链中的胍官能团被转化为乙酰胺官能团。在Arg3中,这些胍官能团被修饰成双氨基甲酸酯官能团。这些氨基甲酸酯官能团均以叔丁基为末端。这些结构性修饰的改变引起了MW和logP值的变化。Arg0、Arg1、Arg2和Arg3的分子量分别为889、917、1085和1317Da,其log P值分别为为-6.67、-4.67、-4.18和-1.75。使用人(尸)体皮肤和纵向Franz扩散池(供体相:含肽的丙二醇水溶液(0,30,50,70,100%),受体相:磷酸盐缓冲液)进行24小时的皮肤渗透研究。Arg2(MW: 1085 Da和clog P:4.18)和Arg3(MW: 1317 Da和clog P: 1.75)显著表现出皮肤渗透性增强。丙二醇是一种加入化妆品中的已知化学增强剂。在纯丙二醇中,与纯水相比,所有肽的皮肤渗透性都更高。对于Arg1、Arg2和Arg3,100%丙二醇溶液的渗透性最高。Arg0的浓度为70%[22]。值得注意的是,当丙二醇浓度为70%时,与其类似物相比,Arg0具有最高的皮肤渗透性,这表明了化学促渗剂的重要性。
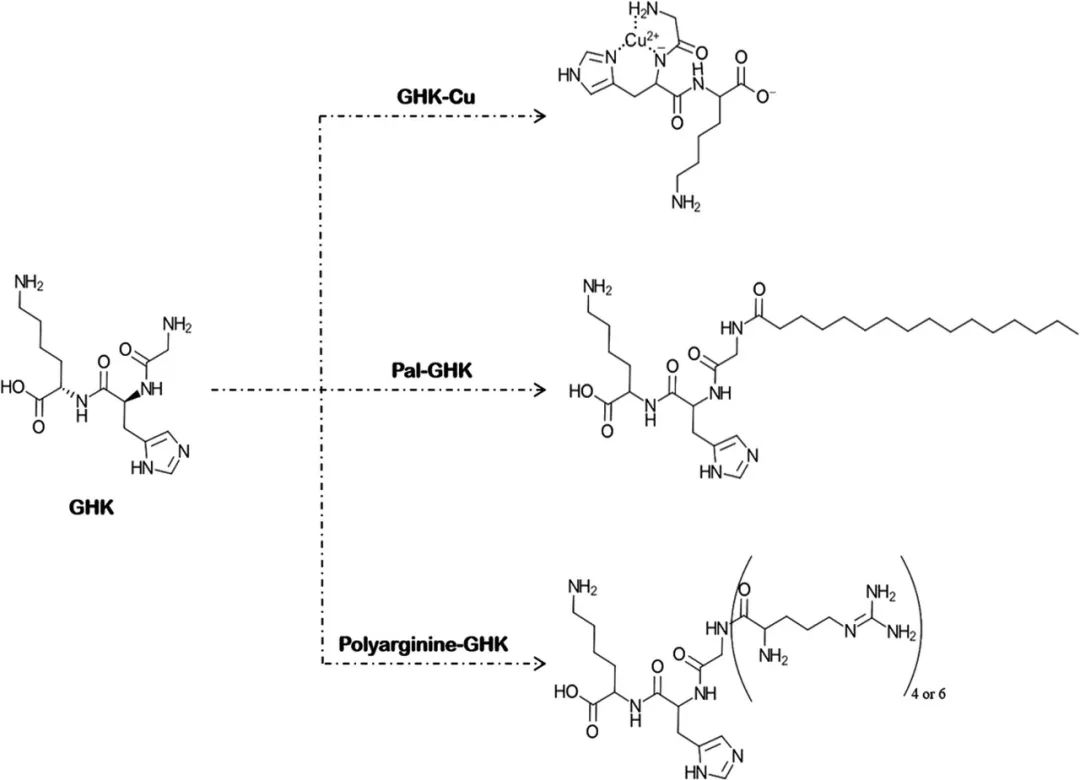
图3.argireline的结构性修饰
一些用棕榈酸进行化学修饰的肽已进入抗衰市场。除上述所提及的Matrixyl®之外,Pal-GHK和Pal-GQPR的组合产品也作为抗皱血清上市,品牌名称为Matrixyl®3000。Pal-GQPR是2018年抗衰老产品中使用最广泛的肽[3]。然而,尚没有关于这种棕榈酰肽渗透性的研究发表。对含有棕榈酸和其他疏水基团的化学修饰肽的皮肤渗透性还需要更多的研究。
细胞穿膜肽细胞穿膜肽(CPP)由5-30个氨基酸组成。尽管根据物理性质,大多数CPPs是聚阳离子的,但还有其他两类,是含两亲性和疏水性结构的。CPP能够穿过膜并输送各种大小的物质,从小分子(例如肽)到大分子(例如蛋白质)。CPPs利用内噬和非内噬通路内化到活细胞内[23–25]。然而,角质层含有死亡细胞,即角化细胞。与分子量相对较低且clogP值高于零的疏水基团相反,CPPs通常是具有亲水性质的大分子。因此,抗皱肽与CPPs的结合不仅增加了肽的分子量,还降低了其进入角质层细胞间脂质基质的倾向。CPPs如何增加皮肤渗透性仍不清楚,但根据文献,这似乎与皮肤蛋白相互作用、改变其二级结构以及诱导细胞间脂质流动性有关[26-28]。使用CPPs的化学修饰不仅会改变亲本肽的结构,还会导致角质层屏障特性的剧烈变化。
事实上,亲本肽扩散系数的修饰是CPPs的主要作用[4]。 三肽-1(GHK)是一种信号肽,可促进胶原蛋白、弹性蛋白、蛋白聚糖和糖胺聚糖的产生。由于GHK能够释放酶促过程所必需的微量元素铜,因此也被归类为载体肽[2]。其分子量为340.4Da,clogP值为-2.24。Park等人评估了GHK(包括GHK、GHK-Cu和Pal-GHK)的皮肤渗透性。他们还研究了精氨酸低聚物(四和六-D-精氨酸、分别为R4,R6)与这些肽的共价连接是如何影响其皮肤渗透性的。GHK及其衍生物的化学结构见图4。将合成表皮(Neoderm®-E)和Franz扩散池(供体相:肽水溶液,受体相:磷酸盐缓冲液,试验持续时间:24h)用于皮肤渗透研究。不同GHKs的皮肤渗透性顺序如下(括号内为累积渗透肽的百分比):Pal-GHK(4.61%)>GHK-Cu(3.86%)> GHK(2.53%)。两种精氨酸低聚物都增加了GHKs的皮肤渗透,但R4表现更好。在GHK与R4的缀合物中,Pal-GHK + R4的皮肤渗透性最好,GHK + R4的皮肤渗透性最差[Pal-GHK+R4(9.79%)>GHK-Cu+R4(8.68%)> GHK+R4(7.61%)][11]。由GHK+ R4显示出比Pal-GHK更高的皮肤渗透性,因此可以得出结论,至少就GHK来说,CPP比疏水基团具有更好的性能。
尽管需要更多的比较研究,但鉴于CPPs和疏水基团的作用机制,CPPs在增加肽的皮肤渗透方面似乎更有效。当然,根据CPPs的皮肤渗透增强机制,当涉及到用CPPs对抗皱肽进行化学修饰的应用时,首先想到的问题之一是其潜在的副作用。不仅需要对使用CPPs制备的肽缀合物进行副作用研究,还需要对通过操纵亲本肽的结构制备的所有肽进行副作用研究,以便将其用于临床应用。
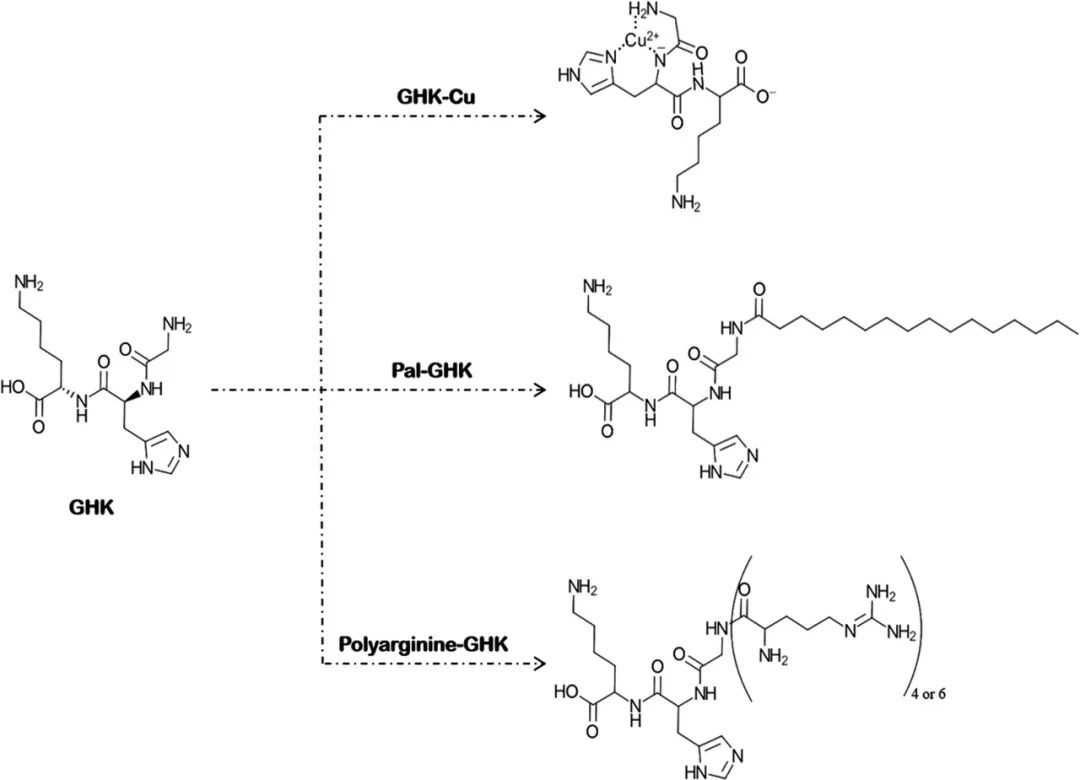
图4.GHK的金属络合和化学修饰
2.2 化学促渗剂
化学促渗剂对角质层的屏障性能有暂时且可逆的降低作用。为此,这些分子通过广泛的机制分配到角质层中并与其成分相互作用。根据化学结构,化学促渗剂可分为醇类、酰胺类、脂肪酸类、酯类、醚醇类、表面活性剂、亚砜类、精油类、萜类及其衍生物、吡咯烷类、噁唑烷类、磷脂类和酶类。化学促渗剂可以通过流化、脂质提取、极性改变和相分离来影响细胞间脂质结构域。它们还可以通过改变桥粒和蛋白质结构来改变角质层粘附的完整性。各机制已在别处进行了全面综述[28–30]。化学促渗剂已成功增加了肽的皮肤渗透性。在皮肤渗透研究中,化学促渗剂以两种方式应用;将化学增强剂与肽的物理混合物暴露于膜,或者最初用化学增强剂处理膜,然后将肽制剂施加于膜上。
肌肽是一种具有抗糖基化活性的抗氧化二肽,因此具有作为抗皱肽的潜力。肌肽(MW:226.23 Da,clog P值:-2.17)及其代谢产物N-乙酰腺苷(MW:268.27Da,clog P值:-2.56)也能减少人皮肤的UVB红斑[31]。与肌肽相反,N-乙酰腺苷已被证明不是肌肽酶的底物。由于N-乙酰腺苷对蛋白酶降解的抗性更强,因此与肌肽相比,它可能是一种更好的抗皱剂。在使用Franz扩散池(供体相:含有肌肽或含和不含PG的N-乙酰腺苷的水分散凝胶(HDG),受体相:磷酸盐缓冲盐水)存在和缺乏作为化学增强剂的1,2-戊二醇(PG)的情况下,Goebel等人研究了肌肽和N-乙酰腺苷的皮肤渗透。PG作为一种两亲性二醇,增加了亲水二肽的皮肤渗透性。已经提出了一些二醇增强效用的机理,包括α-角蛋白的溶剂化、非极性通路的修饰、极性分子分配系数的修饰等。
关于含有肌肽的制剂,无论制剂类型如何(含或不含PG),在受体相中并未检测到肌肽,但在所有皮肤层中均发现了肌肽。角质层中肌肽的含量没有显著差异。100mins后,PG引起了表皮(约为无PG的HDG的6倍)和真皮(约为无PG的HDG的4倍)中积聚了较高含量的肌肽。对于含有N-乙酰腺苷酸的制剂,PG会致使更快和更高的皮肤渗透,因此在1000mins后,在所有皮肤层和受体腔中均检测到57%的N-乙酰腺苷酸应用剂量。不含PG的制剂的N-乙酰腺苷酸量为38%。所有皮肤层中的N-乙酰腺苷含量均高于肌肽。与肌肽相比,有两个可能的原因,即亲水性降低以及对蛋白酶的耐药性增加。研究人员介绍称PG是一种有潜力的亲水性肽增强剂[32]。Lim等人的研究(在化学修饰一节的前面已彻底的阐明)证明了丙二醇对Argirelin®渗透性的增强作用[22]。尽管没有关于其他化学促渗剂对抗皱肽渗透性影响的研究发表,但对LHRH大小的治疗性肽进行的研究表明,二醇、脂肪酸、萜类等也能够增强肽的皮肤渗透[33–35]。
2.3 金属络合
金属络合是指由具有空电子轨道的金属离子和一组具有供电子官能团的配体形成金属络合物的过程。金属离子与配体之间形成的键是配位键或配价键(一种特殊的共价键)。一些肽(如GHK肽和肌肽)可作为配体,与金属离子(如Cu2+和Mg2+)形成配合物。
肌肽是一种多齿配体,可以与Mg2+离子配位形成带正电荷的复合物(图2)。Dissette等人研究了复合剂镁离子对肌肽穿透重建人表皮(呈现所有分化的细胞层)(作为人皮肤组织模型)渗透性的影响。使用菌类植物胶作为胶凝剂,他们制备了三种不同的凝胶:含有1.5%肌肽复合物的凝胶、含有1.5%游离肌肽但不含镁盐的凝胶和含有镁盐的凝胶。24小时和48小时的对比性渗透研究显示,与游离肌肽相比,在使用肌肽复合物后的受体相中检测到的肌肽浓度增加了1.5倍。对48小时后截留在皮肤模型中的肌肽的测量显示,皮肤模型对于游离肌肽和肌肽复合物具有相同的趋向。肌肽复合物皮肤渗透性的增强归因于其能更好地与长链糖胺聚糖和膜蛋白上存在的氮原子电子电荷相互作用。研究人员介绍了金属螯合是一种提高肌肽皮肤渗透性的好方式[31]。 GHK-Cu是化妆品行业中著名的抗皱肽复合物。GHK是一种能够携带Cu2+的信号肽,因此也可用作载体肽。事实上,这种金属络合物是有效抗皱肽和影响衰老过程的金属的结合。成纤维细胞的线粒体产生含铜酶,参与结缔组织的交联。这就是为什么GHK-Cu能作为活性成分被纳入抗衰产品[36]。Park等人进行的研究(详见“细胞穿透肽”部分)显示,GHK-Cu的皮肤渗透性高于GHK,这表明了金属络合对该肽渗透性的增强作用[11]。
03 用于抗皱肽的物理增强方法
已经应用了各种物理增强方法来降低皮肤对渗透物进入的阻力。物理技术遵循了两种基本途径;一是表皮的机械性破坏(例如,微晶磨皮、微针),二是皮肤中的空化或孔道形成(例如,超声促渗和离子电渗作用)[37]。尽管物理方法具有所有优势,但其局限性之一是需要特殊的设备将这些技术应用于临床皮肤上。据UC所知,只有两种物理技术,微针和离子电渗疗法,被用于抗皱治疗的研究。以下讨论了这些技术。
3.1 微针
微针是皮下注射针和透皮贴剂的混合体,其中微米大小的针排列在小贴剂上。有不同穿透深度的微针,它们最重要的特征是其允许药物/化妆品分子通过角质层,角质层是最具挑战性的皮肤屏障[38]。角质层的平均厚度在10–30微米之间,药物输送针头的长度在数百微米之间。这就是为什么微针不会引发痛感反而可以将药剂有效地输送到它们在皮肤中的靶点[39,40]。
Zhang等人使用猪耳皮肤和Franz扩散池(供体相:溶解在磷酸盐缓冲盐水中的肽,受体相:磷酸盐缓冲盐水)研究了微针预处理20秒对三种化妆品肽(包括GQPR(MW: 456.6 Da)、VGVAPG (MW: 498.6 Da)和乙酰基六肽-3(MW: 889 Da)以及一种治疗性九肽(包括催产素(MW:1007.2 Da))的皮肤渗透性的影响。图5中呈现了所提及的美容肽的结构。为了调查作为亲水化合物的乙酰基六肽-3的运输是如何被微针影响的,根据亲水溶质和载体运输之间的关系,在渗透研究中还测试了溶解在用D2O制造的磷酸盐缓冲盐水中的乙酰基六肽-3的供体相,并且研究了D2O通量以及乙酰基六肽-3的渗透清除率。固体微针的长度为150μm。使用包被有钙黄绿素水凝胶的微针进行皮肤预处理后获得的共聚焦激光扫描显微镜图像证实,使用微针进行预处理可在皮肤中形成微导管。观察到钙黄绿素荧光在皮肤深度达80微米时的分布。在使用微针和不使用微针(被动扩散)的皮肤渗透研究中获得的数据之间的比较表明,微针可以显著增强肽的渗透性。暴露24小时后,催产素、乙酰基六肽-3、VGVAPG和GQPR的增强率分别约为58、38、36和32。结果还显示,D2O通量与乙酰基六肽-3清除率之间存在适当的相关性,这表明了微针产生的对流对肽的皮肤渗透性的重要性及影响[41]。
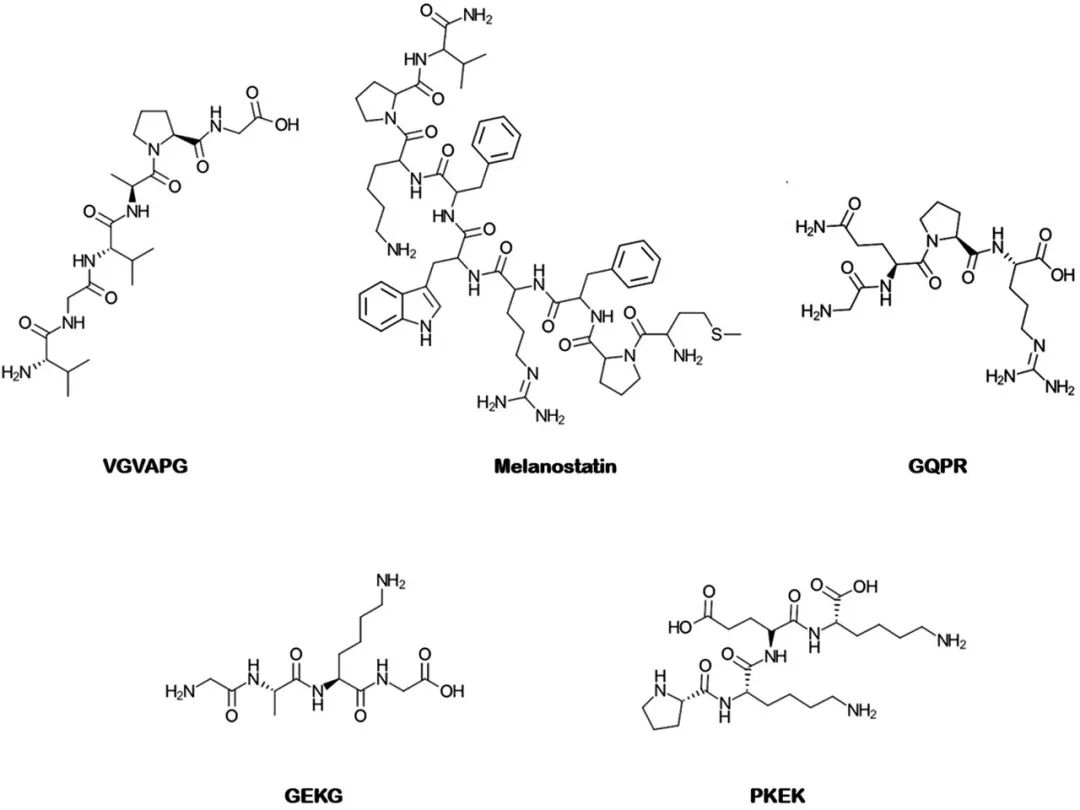
图5. 经过物理方法和包封方法处理的抗皱肽的化学结构
Mohammed等人使用共焦显微镜评估了不同链长的荧光标记肽(黑素抑制素、GQPR和Pal-KTTKS)的被动扩散和微针促渗。图2和5中显示了提及的肽的化学结构。使用700μm的微针对人皮肤进行预处理显著增加了黑素抑制素和GQPR的渗透,但这种技术对于本研究中最大的肽(即Pal-KTTKS)是无效的。研究人员讨论称单纯地在皮肤中产生孔道并不意味着能增加所有类型的肽的渗透性,应针对每一种特定的肽来定制促渗技术[42]。
为了确定微针的几何形状和曲率对抗皱肽(乙酰基-六肽3)皮肤渗透的影响,Lim等人使用3DM可浇铸树脂通过3D打印制造了特制微针眼贴片。使用人(尸)体皮肤和Franz扩散池,研究了乙酰基六肽-3在完整皮肤、用特制微针眼贴片处理的皮肤和用市售扁平微针贴片处理的皮肤上24小时后的皮肤渗透。供体相为10%w/v浓度的乙酰基六肽-3溶液,受体相为磷酸盐缓冲盐水。在皮肤渗透研究中还使用了一种含有乙酰基六肽-3的市售透皮贴剂。基于这些结果,使用特制微针贴片处理的皮肤中肽的累积渗透量分别是完整皮肤和使用柔性微针贴片处理的皮肤的90倍和45倍。对于含有乙酰基六肽-3的市售贴剂,在受体相中未发现可检测含量的肽。除了特制微针眼用贴片与含有乙酰基六肽-3的市售贴片之间的比较外,所有治疗组,在皮肤中捕获的肽总量在统计学上没有差异。与扁平微针贴片相比,特制微针贴片预处理的皮肤渗透性更好,这强调了在使用过程中使微针贴片贴合皮肤表面的重要性[43]。
上述研究是关于固体微针预处理对抗皱肽皮肤渗透性的影响。其他类型的微针,如:包被微针、可溶微针和中空微针[44]。这些类型的微针尚未考虑在抗皱肽领域使用。
3.2 离子电渗疗法
离子电渗疗法是一种物理技术,其中使用生理学上可接受的电流来传输分子穿过皮肤[45]。电斥力(驱动带电分子穿过皮肤)和电渗(在膜中产生携带带电和不带电分子的大量液流)的机制导致离子电渗过程对带电和不带电分子都有效用[46,47]。这种物理渗透增强的方法可能有助于肽的皮肤递送。关于药物和模型肽的离子电渗递送已有许多已发表的研究[33,34,48,49],但谈及抗皱肽时,文献的匮乏是显而易见的。
各种参数会影响离子电渗疗法的效果。Krishnan等人研究了与制剂相关的参数(如浓度、pH和竞争离子的存在)、与离子电渗疗法过程相关的参数(如施加电流的方向:阳极与阴极)以及与渗透剂相关的参数(如分子大小和电荷)对肽的皮肤渗透性的影响[47]。渗透物按分子量增加的顺序有小肽样药物(5-氨基乙酰丙酸)、模型二肽(丙氨酸-色氨酸)、治疗性四肽(丙氨酸-丙氨酸-脯氨酸-缬氨酸;AAPV)、美容肽(乙酰基六肽-3)和治疗性十肽(醋酸曲普瑞林)。采用人表皮膜、Ag/AgCl电极的0.4 mA恒定离子电渗电流和带有电解质溶液(20 mM HEPES + 137 mMNaCl)受体相的并排扩散池进行渗透研究。与被动渗透相比,离子电渗疗法致使所有肽的皮肤渗透增加了30倍。对于低分子量带电荷的肽,电斥力是相当大的。对于高分子量带电肽,电渗是一个重要的决定参数。根据文献,与较小的肽相比,大肽所携带的总电流比例非常小[48]。在较低的pH值下,渗透率降低,这可能是由于电渗作用降低所致。供体腔中背景电解质的存在降低了全部肽的离子电渗递送,这可能是由于离子强度的增加,从而增加了电荷载体之间的竞争所导致。电渗的减少被认为是另一个可能的原因。供体相中肽浓度的增加致使肽离子电渗通量增加,离子电渗渗透系数降低,因为通量增加并不等同于浓度增加。离子电渗疗法的电荷饱和可能是该事件的一个可能的原因。电流方向对仅针对AAPV和乙酰基六肽-3(两种肽pH在 7.4下)进行的离子电渗递送影响的研究表明,尽管AAPV具有负电荷,但对其与电流方向无影响,这表明对于该肽的离子电渗渗透而言电斥力和电渗这两种机制很重要。在pH 7.4时,乙酰基六肽-3的净电荷为零,因此电渗是其离子电渗疗法渗透的主要机理。因此,阳极电流下乙酰基六肽-3的离子电渗疗法的渗透系数约是阴极电流下的14倍。在本研究中已经很好地彰显了将各种参数调节到最佳水平对于获得最佳离子电渗疗法的肽递送的重要性[47]。
04 抗皱肽在脂质纳米载体中的包封
近年来,人们对纳米技术的兴趣越来越大,这种创新技术的痕迹可以在许多领域看到,包括化妆品领域。利用基于纳米的递送系统来有效地递送化妆品成分已经引起了人们的广泛关注,抗皱肽也不例外。众多纳米载体已被用于化妆品研究,但其中许多载体尚未被研究用于增加抗皱肽的皮肤渗透。以下是对研究尝试的综述,其中调查了将抗皱肽包封到纳米载体中对肽的皮肤渗透性的影响。以下就抗皱肽包封于纳米载体对其皮肤渗透性的影响进行综述。
4.1 磷脂囊泡纳米载体
脂质体是化妆品行业最早获得成功的体系之一。1986年,Christian Dior推出了第一款以CaptureTM品牌命名的脂质体抗衰老霜[50]。脂质体是由至少一个磷脂双层包围的亲水核组成,可用于装载亲水物质和疏水物质[51]。传递体和醇质体是其他类型的基于磷脂的囊泡体系,它们比脂质体更具柔韧性和弹性。这些弹性囊泡呈现出比脂质体更好的皮肤渗透性。传递体的主要特征是在其结构中存在引起变形性的边缘活化剂(例如单链表面活性剂)。醇质体的结构中含有乙醇分子。乙醇是一种化学促渗剂,可以流化醇质体结构中的脂质以及角质层中的脂质[52]。本章节并非关注磷脂囊泡体系的特征和组成。如需了解详情,请阅读参考文献[53]。磷脂囊泡体系如何增加装载物质的皮肤渗透性仍有争议。这些假设包括完整囊泡通过角质层的细胞间脂质基质的皮肤渗透、组分的渗透增强作用以及完整囊泡通过经附件途径的皮肤渗透[54]。对于常规脂质体,通过附件途径的可能性更大,如毛囊,而对于柔性脂质体,通过附件途径和细胞间脂质基质的可能性更大,如传递体和醇质体。
为了改善Pal-KTTKS的皮肤渗透性,Kim等人利用大豆磷脂酰胆碱、乙醇和不同脂肪酸(C10、C12、C14、C16、C18)设计了名为transformer-ethosomes的新型载体。然后将这些载体与脂质体和醇质体在增加Pal-KTTKS渗透性的灵活性和能力方面进行比较。与其他transformer-ethosomes以及脂质体和醇质体相比,磷脂双层中含有癸酸(C10)和肉豆蔻酸(C14)的transformer-ethosomes呈现出最小的转化温度和最大的灵活性。使用扩散池进行的人工膜皮肤渗透研究表明,当使用含Pal-KTTKS的15%乙醇溶液、脂质体或醇质体作为供体相时,24小时后在受体相中未发现可检测含量的肽。然而,所有类型的transformer-ethosomes均致使在受体相中可发现Pal-KTTKS。结果表明,链较短的饱和脂肪酸对脂双层的柔韧性和Pal-KTTKS的通透性均有较大影响。在transformer-ethosomes中,最具渗透性的是那些含有癸酸或肉豆蔻酸的物质。癸酸和肉豆蔻酸改变了磷脂双层的流动性,从而提高了transformer-ethosomes挤过角质形成细胞间孔隙的能力。此外,乙醇和脂肪酸都可以作为化学皮肤促渗剂。使用具有荧光标记物(若丹明-6G)的共聚焦激光扫描显微镜的皮肤渗透研究表明,在经4h暴露后,在15%乙醇溶液的情况下仅在角质层中发现荧光探针,而在脂质体和醇质体中,标记物可以到达表皮基底层。在transformer-ethosomes中观察到了荧光探针向真皮最下层的渗透。这种可变形的磷脂囊泡似乎一种有前景的载体,其可将信号肽如Pal- KTTKS递送至其在真皮中的作用位点[55]。
4.2 液晶纳米粒子
液晶是研究人员已经考虑用于各种美容目的的另一递送系统[56,57]。液晶或中间相是介于液态和固态之间的中间状态。因此,有些液晶的性质类似于液体(如流动性),有些(如结构顺序)类似于固体。中间相有两大类,热致性和溶致性。热致性中间相是因温度变化形成的,而溶致性中间相是在一定温度下,向一定量的两亲性分子中加入溶剂形成的[58,59]。溶致性中间相作为药物递送系统备受关注。溶致性中间相有三个主要类别,即层状、立方形和六边形中间相。亲水性和亲脂性物质均可并入溶致性中间相。液晶可以在纳米尺度上制备;立方小体和六胞体是两个常见的例子[60]。为获得合适的Pal- KTTKS皮肤递送系统,Selvaraj等人制备了粒径小于300 nm、包封率大于99%的液晶纳米粒子。液晶纳米粒子由磷脂酰胆碱、单油酸甘油酯和不同浓度的部分水解人参皂苷制备。将全层猪皮和Franz扩散池(供体相:含Pal-KTTKS和含和不含脂肪酶的磷酸盐缓冲盐水(50:50 v/v)的液晶纳米颗粒,受体相:磷酸盐缓冲盐水)用于皮肤渗透和滞留研究。研究人员利用供体相中的脂肪酶研究了液晶纳米粒子是否能稳定Pal-KTTKS对酶的作用。液晶纳米粒子增加了Pal-KTTKS的皮肤渗透性和滞留性。在缺乏和存在脂肪酶的情况下,载有Pal-KTTKS的液晶纳米粒子的稳态通量分别是丙二醇中溶解的Pal-KTTKS的4.6倍和6倍。结果还显示,随着部分水解的人参皂苷的浓度增加,Pal-KTTKS的皮肤渗透性和滞留量增加。研究者得出,该化合物可用作皮肤渗透促进剂[61]。
尽管液晶已经成功地用于递送化妆品成分,例如视黄醇、白藜芦醇、抗坏血酸[56,62,63],但它们作为肽递送系统的应用还没有像其它基于脂质的递送系统那样普遍。因此,对于含抗皱肽的液晶十分需要进一步的研究。
4.3 微乳液
微乳液是一种稳定的胶体体系,由三至四种主要成分组成;水、油、表面活性剂和助表面活性剂。虽然微乳一词中使用了micro的前缀,但微乳的液滴尺寸<100 nm。有望将亲水性和疏水性物质混合到微乳液中。微乳液具有增强皮肤渗透的特性,并已被广泛用作向皮肤递送不同物质(药物或化妆品)的载体[64]。表面积/体积比大、单个组分的作用、皮肤水合作用的增高和高负载能力均被认为是微乳液增加皮肤渗透性的机理[65]。
PKEK是一种能够抑制色素沉着过程的四肽(化学结构见图4 )。为此,该肽必须要到达表皮细胞的基底层。由于其MW为500.6 Da,clogP值为–2.53,并且存在多种可电离基团;对于PKEK来说,实现此目标具有挑战性。利用人皮肤和Franz扩散池,比较了W/O微乳液与标准乳膏的PKEK渗透性。受体相为磷酸盐缓冲液。在30mins、100mins、300 mins后测定皮肤不同深度中的肽的浓度。使用含有PKEK的两种制剂后,观察到皮肤中肽的浓度梯度显著。随着时间的推移,皮肤中的肽浓度增加。微乳液和标准乳膏30 mins后在皮肤上残留的肽的百分比分别为48%和42%。100 mins和300 mins后,微乳液的残留肽百分比明显高于标准乳膏;这表明当肽被掺入微乳液中时肽具有更高的皮肤渗透性。就角质层而言,尽管30mins后标准乳膏和微乳液的渗透肽百分比相似,但与微乳液相比,在100和300分钟后在角质层中检测到的标准乳膏中PKEK的百分比显著更高。
相反,与标准乳膏相比,在皮肤上涂抹微乳液后,在受体相中检测到的PKEK百分比标准乳膏更高。一般来说,当使用标准乳膏时,肽主要留存在角质层中,而微乳液则允许更高含量的PKEK到达更深的皮肤层[66]。 GEKG如果达到真皮靶点,可减少皱纹并改善皮肤表观。其化学结构如图4所示。在另一项旨在了解微乳液对肽渗透性影响的尝试中,前一组比较了来自标准乳膏、W/O纳米载体系统和含有增强剂(辛酸甘油酯/辛酸酯)的GEKG (MW: 389.4,clog P:2.58)的皮肤渗透性。渗透研究中使用了Franz扩散池和人皮肤。与先前的研究一样,结果显示,使用标准乳膏后,皮肤表面和角质层中仍残留大量GEKG。化学增强剂略微增加了GEKG对角质层和活性表皮的渗透。微乳液是最佳的制剂,可使高百分比的肽通过皮肤[67]。
根据这些研究,尽管微乳液呈现出递送美容肽的前景,但对这一领域的进一步研究仍非常必要。表2. 呈现了所提及的由不同增强方法增加抗皱肽皮肤渗透性的全部研究的总结。
| 肽 | 增强方法 | 膜类型 | 结论 | 文 献 |
| 肌肽 | 络合(肌肽-镁) | 表皮模型 | 应用肌肽复合物后培养基中肌肽浓度提高1.5倍。 | 31 |
| 化学促渗剂(戊二醇) | 人体皮肤 | 戊二醇导致更大量的肌肽在表皮和真皮中积累。 | 32 | |
| GHK | 化学修饰(Pal-GHK,精氨酸低聚物-GHK)和络合(GHK-铜) | 人工表皮 | 就渗透率而言:Pal-GHK + R4 > GHK-Cu + R4 > GHK + R4 | 11 |
| PKEK | 微乳液 | 人体皮肤 | 微乳液允许更高含量的PKEK到达更深的皮肤层。 | 66 |
| GEKG | 化学促渗剂(辛酸甘油酯/辛酸酯)和微乳液 | 人体皮肤 | 化学增强剂略微增加了GEKG的渗透率。微乳液致使高百分比的肽通过皮肤 | 67 |
| 化学修饰(Cit-KTTKS和Per-KTTKS) | 人体表皮 | 只有Cit-KTTKS渗透到人表皮中,kp为7.3×10-4cm/h。 | 14 | |
| Pal-KTTKS | 液晶纳米粒子 | 猪皮肤 | 液晶纳米粒子增加了两种皮肤的渗透性和滞留性 | 61 |
| 脂质体 | 人工皮肤 | 与Transformer-ethosomes相反,就脂质体和醇质体在受体相中无可检测到的量。 | 55 | |
| 醇质体 | ||||
| Transformer-ethosomes | ||||
| 微针 | 人体皮肤 | 对Pal-KTTKS该技术无效。 |
42 |
|
| GQPR | 微针 | 人体皮肤 | 增强率=32 | 41 |
| 促黑素抑制素 | 微针 | 人体皮肤 | 增强了皮肤渗透性 | 42 |
| 乙酰基六肽-3 | 结构修饰和化学渗透增强剂(丙二醇) | 人(尸)体皮肤 | 在所有衍生物中,100%丙二醇溶液的渗透率最高。亲体肽的此浓度为70%。 | 22 |
| 微针 | 人(尸)体皮肤 | 增强率=38 | 41 | |
| 离子电渗疗法 | 人体皮肤 | 增强率=6.8 | 47 | |
| VGVAPG | 微针 | 人(尸)体皮肤 | 增强率=36 | 41 |
Note:除 [31] 外,所有渗透研究均使用扩散池进行。
05 结论
抗皱肽作为活性成分在护肤品中的应用是化妆品行业当前备受关注的领域。许多已发表的研究证实了此类肽的抗皱性能,但其皮肤渗透性尚未得到证实。大多数抗皱肽不具有用于皮肤递送的理想渗透的特征,并且还必须使用增强方法来增加它们的渗透性。尽管有众所周知的化学、物理和包封方法来增强聚合物和大分子的皮肤渗透,但对于抗皱肽,目前为止已经采用了其中的一些方法(但并非全部)。化学修饰、络合、化学促渗剂、离子电渗疗法、微针和纳米载体包封已呈现出对增加抗皱肽的皮肤渗透性的前景。当然,还需要进一步的研究来确定每种增强方法的优缺点。应始终注意,抗皱产品由化妆品消费者使用,因此增加肽皮肤渗透的方法不可有损产品的吸引力。尽管UC希望抗皱肽具有更高的皮肤渗透性,但也不能忽视应用增强方法可能会引起的皮肤副作用。关于抗皱肽的皮肤渗透增强仍有许多问题没有得到解答,如电穿孔、超声、多极射频以及大多数化学增强剂对这些难溶性分子的渗透率的影响。因此,需要进一步研究找出抗皱肽的最佳渗透增强策略。
原文链接: 点击查看
相关推荐:
