为了论证产品对安全和性能基本原则的符合性,医疗器械产品注册申报过程应当进行临床评价。开展医疗器械临床评价,可以根据产品特征、临床风险、已有临床数据等情形,通过开展临床试验,或者通过对同品种医疗器械临床文献资料、临床数据进行分析评价,证明医疗器械的安全性、有效性。
对于如何选择医疗器械临床评价路径,国家药品监督管理局已陆续发布多项通用性指导原则,国家局医疗器械技术审评中心也发布了针对各子目录产品的临床评价推荐路径(见附录)。
本文主要介绍了医疗器械临床评价路径决策的分析思路,以便企业更好的通过非临床试验的方式完成临床评价。
1. 什么下情况医疗器械产品需要进行临床评价?
(1) 未列入《免于临床评价医疗器械目录》(国家局2021年第71号通告)的第二类、第三类医疗器械需要进行临床评价。
(2) 列入《免于临床评价医疗器械目录》中,但是:
a. 医疗器械产品的适用范围超过了免临床评价目录的描述内容;
b. 虽然符合免临床评价目录的描述内容,但是找不到同类产品;
c. 虽然符合免临床评价目录的描述内容,但是与同类产品的差异会影响产品的安全有效性,会出现同类产品不存在的且可能引发重大风险和/或引起显著影响有效性的问题;
2.医疗器械临床评价路径
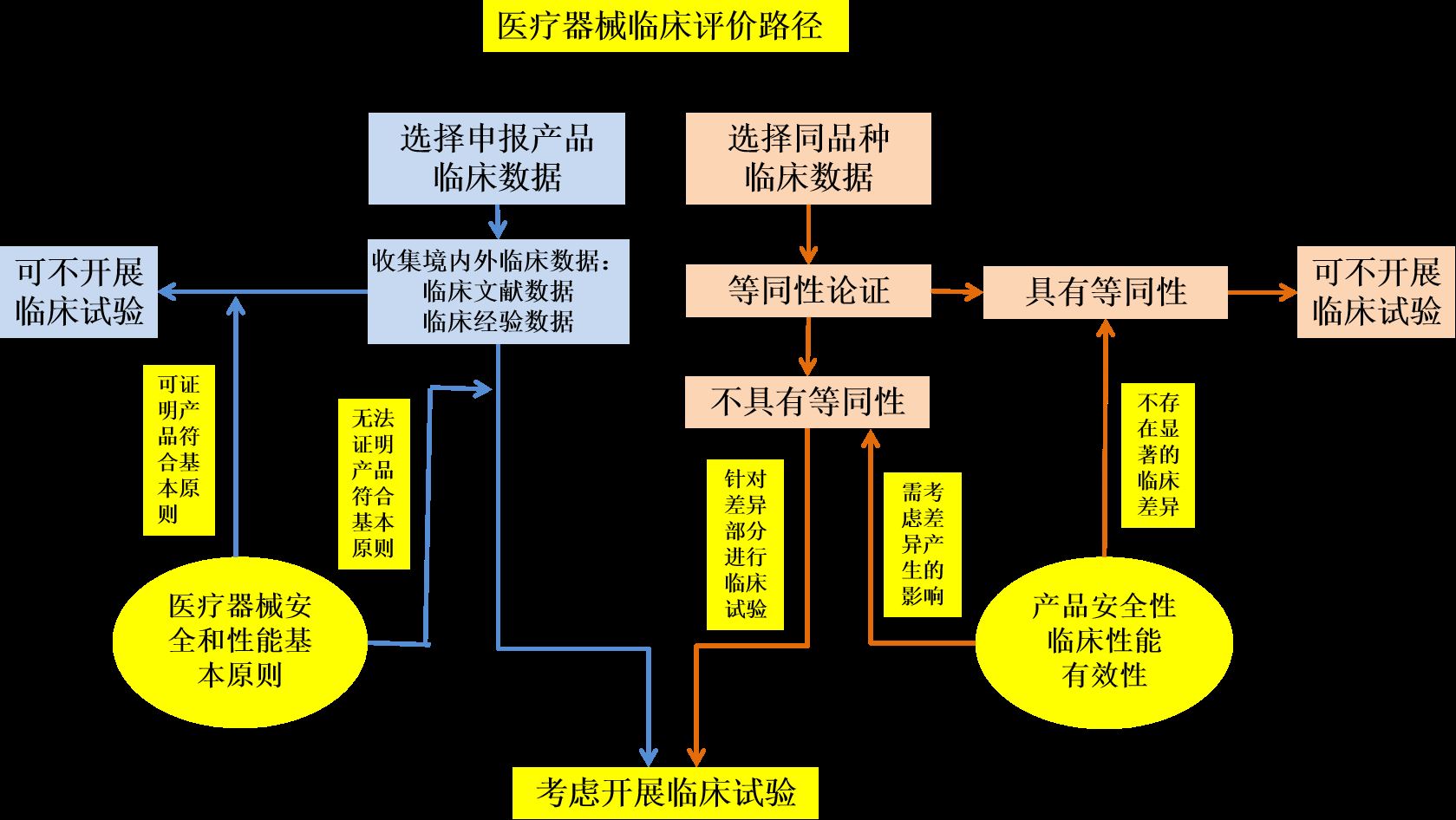
3.医疗器械临床评价基本流程
(1) 识别需要临床数据支持的安全和性能基本原则;
(2) 识别与产品及其适用范围相关的可用的临床数据;
(3) 根据产品在适用范围下的安全性、临床性能和/或有效性的论证需要,评价临床数据的适宜性和贡献;
(4) 在上述流程的基础上,根据安全性、临床性能和/或有效性剩余问题的解决需要,产生新的临床数据;
(5) 汇总所有临床数据,得出产品安全性、临床性能和/或有效性的结论。
企业若对如何正确选择临床评价路径、如何规避或降低临床试验要求等具体问题还有不理解的地方可参加瑞旭集团-北京西尔思联合杭州天和高科技产业园有限公司在2022年10月28日举办的“医疗器械&体外诊断试剂临床评价技术研讨会”,欢迎各企业参会讨论。
附录 医疗器械临床评价指导文件
|
发布年份 |
法规名称 |
|
2018年 |
总局关于发布医疗器械临床试验设计指导原则的通告(2018年第6号) |
|
食品药品监管总局关于发布接受医疗器械境外临床试验数据技术指导原则的通告(2018年第13号) |
|
|
2020年 |
国家药监局关于发布真实世界数据用于医疗器械临床评价技术指导原则(试行)的通告(2020年第77号) |
|
2021年 |
国家药监局关于发布免于临床评价医疗器械目录的通告(2021年第71号) |
|
国家药监局关于发布医疗器械临床评价技术指导原则等5项技术指导原则的通告(2021年第73号) |
|
|
附件1 医疗器械临床评价技术指导原则(国家局2021年第73号通告) |
|
|
附件2 决策是否开展医疗器械临床试验技术指导原则(国家局2021年第73号通告) |
|
|
附件3 医疗器械临床评价等同性论证技术指导原则(国家局2021年第73号通告) |
|
|
附件4 医疗器械注册申报临床评价报告技术指导原则(国家局2021年第73号通告) |
|
|
附件5 列入免于临床评价医疗器械目录产品对比说明技术指导原则(国家局2021年第73号通告) |
|
|
2022年 |
关于发布《医疗器械分类目录》子目录11、12、13、14、15、17、22相关产品临床评价推荐路径的通告(2022年第20号) |
|
关于发布《医疗器械分类目录》子目录02、03、05、06、16、18、20相关产品临床评价推荐路径的通告(2022年第24号) |
|
|
关于发布《医疗器械分类目录》子目录01、04、07、08、09、10、19、21相关产品临床评价推荐路径的通告(2022年第30号) |
