为进一步规范无源植入性医疗器械货架有效期研究资料的注册申报和技术审评,国家药品监督管理局医疗器械技术审评中心组织起草了《无源植入性医疗器械货架有效期注册申报资料指导原则(2021年修订)》(征求意见稿),现公开征求意见。
请相关领域的专家、学者、生产企业及有关从业人员提出宝贵意见和建议。相关意见或建议,请下载并填写附件中的《无源植入性医疗器械货架有效期注册申报资料指导原则(2021年修订)》(征求意见稿)反馈意见表,并于2021年7月8日前将反馈意见以电子邮件形式反馈我中心。
联系人:李芬
电 话:010-86452670
电子邮箱: lifen@cmde.org.cn
附指导原则:
无源植入性医疗器械货架有效期注册申报 资料指导原则( 2021修订版)(征求意见稿)
一、 前言
医疗器械货架有效期是指保证医疗器械终产品正常发挥预期功能的期限,一旦超过医疗器械的货架有效期,就意味着该器械可能不再满足已知的性能指标,发挥预期功能,在使用中具有潜在的风险。为进一步明确无源植入性医疗器械产品注册申报资料的技术要求,指导注册申请人编制无源植入性医疗器械货架有效期注册申报资料,特制定本指导原则。无源非植入性医疗器械有关货架有效期注册申报可根据实际情况参照执行。
本指导原则系对无源植入性医疗器械货架有效期的一般性要求, 未涉及其他技术要求。对于产品其他技术要求有关注册申报资料的准备,注册申请人还需 参考 相关的法规和指导性文件。 如有其他法规和指导性文件涉及某类医疗器械货架有效期的具体规定,建议 注册申请人 结合本指导原则一并使用。
本指导原则系对注册申请人 和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行。如果有能够满足相关法规要求的其他方法,也可采用,但宜提供详细的研究资料和验证资料。 注册申请人 应在遵循相关法规的前提下使用本指导原则。
本指导原则是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及 科学技术的 不断发展,本指导原则相关内容也将进行适时的调整。
本指导原则 是原国家食品药品监督管理总局发布的 《 无源植入性医疗器械货架有效期注册申报资料指导原则 》 ( 2017 年 修订版 ) 的 再 修订版 。
二、适用范围
本指导原则主要适用于无源植入性医疗器械货架有效期的研究及相关注册申报资料的准备。
三、基本要求
(一)货架有效期影响因素 的 考虑
影响医疗器械货架有效期的因素主要包括外部因素和内部因素。此处列举了部分与无源植入性医疗器械密切相关的影响因素,但不仅限于以下内容:
外部因素主要包括:
1. 储存条件,例如温度、湿度、光照、通风情况、气压、污染等;
2. 运输条件,例如运输过程中的震动、冲撞;
3. 生产方式,采用不同方式生产的同一医疗器械产品可能具有不同的货架有效期;
4. 生产环境,如无菌医疗器械生产场所的洁净度、温度和湿度、微生物及悬浮粒子负荷等;
5. 包装,例如在不同尺寸容器中包装的产品可能具有不同的货架有效期;
6. 原辅材料改变的影响,如来源 、 质量 、 稳定性 等 ;
7. 其他影响因素,如生产设备改变的影响及设备所用清洗剂、脱模剂的影响。
内部因素主要包括:
1. 医疗器械中各原材料 / 组件自身 随 时间的推移而发生退化 的 特性 , 如某些高分子材料 、药械 组合产品中的药物 成分 、生物活性因子等。
2. 医疗器械中各原材料 / 组件之间可能发生的相互作用。
3. 医疗器械中各原材料 / 组件与包装材料(包括保存介质,如角膜接触镜的保存液等)之间可能发生的相互作用。
4. 生产工艺对医疗器械中各原材料 / 组件、包装材料造成的影响,如生产过程中采用的灭菌工艺等。
5. 医疗器械中含有的放射性物质和其放射衰变后的副产物对医疗器械中原材料 / 组件、包装材料的影响。
6. 无菌包装产品中微生物屏障的保持能力。
内部因素和外部因素均可不同程度地影响医疗器械产品的技术性能指标,当超出允差后便可造成器械失效。由于影响因素很多, 注册申请人 不可能将全部影响医疗器械货架有效期的因素进行规避, 但宜尽可能将各因素进行有效控制,使其对医疗器械技术性能指标造成的影响降至最低。
需要强调的是,并不是所有的医疗器械均需要有一个确定的货架有效期。当某一医疗器械的原材料性能和包装材料性能随时间推移而不会发生显著性改变时,则可能没有必要确定一个严格的货架有效期,而当某一医疗器械的稳定性较差或临床使用风险过高时,其货架有效期则需要进行严格的验证。对于以无菌状态供应的无源植入性医疗器械, 注册申请人 宜 指定一个经过验证的确定的货架有效期。
(二)货架有效期验证过程
医疗器械货架有效期的验证贯穿该器械研发的整个过程, 注册申请人 宜在医疗器械研发的最初阶段考虑 如何设定 货架有效期,并在产品的验证 、 改进过程 以及上市后 不断进行确认。
首先, 注册申请人 要为医疗器械设定 合理的货架有效期, 以保证 其在规定的贮 存、 运输条件下能维持预期功效 。
其次, 注册申请人 需对用于生产和包装医疗器械的材料、组件和相关生产工艺,以及涉及到的 背景 资料进行全面评估。必要 时 ,还需进行实验室验证和调整生产工艺。
注册申请人 根据评估结果 合理 设计医疗器械的货架有效期验证方案,并依据方案所获得的验证结果确定该医疗器械的货架有效期。如验证结果不能被 注册申请人 所接受,则需对其进行改进,并于改进后重新进行验证。
最后, 注册申请人 需要 通过 严格的质量体系确保产品在 货架有效期内和确定的条件下 进行储存、运输和销售 。
注册申请人 应认真保存医疗器械货架有效期验证过程中涉及的各种文件和试验数据,以便在申请注册时和对货架有效期进行重新评价时提供详细的支持性资料。
(三)货架有效期验证内容
1. 验证试验
医疗器械货架有效期的验证试验通常可 包括 加速稳定性试验 、 实时稳定性试验 等 [ 1,3 ] 。
( 1 )加速稳定性试验
加速稳定性试验是指将某一产品放置在外部应力状态下,通过考察应力状态下的材料退化情况,利用已知的加速因子与退化速率关系,推断产品在正常储存条件下的材料退化情况的试验。
加速稳定性试验设计是建立在假设材料变质所涉及的化学反应遵循阿列纽斯 ( Arrhenius) 反应速率函数基础上的 ,但并不是所有材料的化学反应速率随温度变化关系均符合该函数,许多 用于高分子材料医疗器械的加速老化试验是根据该方程的 零 级、一级和假一级化学反应 估算 的 [5] 。 该函数以碰撞理论为基础,确认化学反应产生变化的反应速率的增加或降低按照以下公式进行:
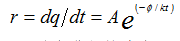
r
:反应进行的速率;
A
:材料的常数(频率因子);
![]() :表观活化能(
eV
);
k
:波尔兹曼常数(
0.8617
×
10-4
e
V/K
);
t
:绝对温度。
:表观活化能(
eV
);
k
:波尔兹曼常数(
0.8617
×
10-4
e
V/K
);
t
:绝对温度。
大量化学反应的研究结果表明温度升高或降低 10℃ 会导致化学反应速率增加一倍或减半。则可根据阿列纽斯反应速率函数建立加速老化简化公式:
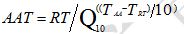
AAT: 加速老化时间; RT :实时老化时间; Q 10 :温度升高或降低 10℃ 的老化系数; T AA :加速老化温度; T RT : 预设 的实际 储存 温度 环境 温度 。
上述公式反映了加速稳定性试验中加速老化时间与对应的货架有效期的关系。其中, Q 10 一般设定为 2 [1,3,5] 。当 注册申请人 对医疗器械和包装的材料的评估资料不齐备时, Q 10 可保守设定为 1.8 。如 注册申请人 在加速稳定性试验中设定的 Q 10 大于 2 ,则宜同时提供详细的相关研究资料。 T RT 宜能够 代表产品实际 储存使用条件下 的 温度。对于预期 在 室温环境下储存 的产品, T RT 一般设定在20-25℃之间,选择25℃ 更加保守一些,可结合说明书 / 标签中的预期储存温度、同类产品历史数据、材料和 / 或包装稳定性数据等设定 T RT ,建议不低于22℃ [ 4] 。
此外,设定较高的加速老化温度可减少加速稳定性试验的时间。但是,由于较高的温度 (如高于聚合物玻璃化转变温度) 可能导致医疗器械原材料 / 组件和包装材料的性质发生改变或引发多级或多种化学反应,造成试验结果的偏差。因此,加速老化温度一般不宜超过 60℃ 。如 注册申请人 在加速稳定性试验中设定了更高的加速老化温度,亦宜提供详细的相关研究资料。
需 要说明的是,当医疗器械的原材料 / 组件在高温状态下易发生退化和损坏时,则不宜采用加速稳定性试验验证其货架有效期。
( 2 )实时稳定性试验
有些 医疗器械不适用于 采用 加速稳定性 验证的 ,需要进行实时稳定 性 验证,如药械组合产品、可降解材料,生物活性材料等。实时稳定性试验是指将某一产品在预定的储存条件下放置,直至监测到其性能指标不能符合规定要求为止。
实时稳定性试验中, 注册申请人 宜根据产品的实际生产、运输和储存情况确定适当的温度、湿度、光照等条件,在设定的 观察时间点 对产品进行测试。 对预期 在 室温环境下储存的 产品 开展实时稳定性研究时,根据储存环境温度记录得出的平均动力学温度(MKT)不宜低于中国气候带(亚热带)的平均动力学温度 ( 22℃) [ 4 ] ,如果MKT≥25℃则更保守 。 申请人可结合说明书 / 标签中的预期储存温度、已有同类 产品 历史数据、产品及包装材料特性等因素设定实时老化温度。如有 针对特定产品的 指导原则或标准, 则 应 遵循相应产品的指导原则 或标准。以医疗器械为主的药械组合产品中药品部分稳定性研究宜参考药品相关规定。
实时稳定性试验结果是验证产品货架有效期的直接证据。当加速稳定性试验结果与其不一致时, 应 以实时稳定性试验结果为准。 如医疗器械 通过加速 稳定性 试验获得 的数据支持其 上市, 上市后需 继续进行实时稳定性研究,并根据研究 结果确定是否需 对货架有效期进行 修正 。
( 3 )其他
有些 医疗器械 货架 有效期验证需考虑 相对 湿度 对 稳定性的影响,宜提供相对湿度的选择依据。
医疗器械货架有效期验证过程中,宜考虑运输条件的影响,如极端温度、 振荡、 跌落 等 。
对于易发生相分离、黏度减小、沉淀或聚集的医疗器械宜通过低温或冻融试验来补充验证其运输的稳定性。
必要时 ,老化 前 或老化后宜对 用于稳定性研究 的终产品进行 模拟 运输 处理 。
2. 验证试验 测试/ 评价项目
无论加速稳定性试验还是实时稳定性试验, 注册申请人 均需在试验方案中设定测试项目、测试方法及判定标准。 测试 项目 仅需评估产品随时间老化的相关性能, 包括产品自身性能测试和包装系统性能 测试 两方面。前者需选择与医疗器械货架有效期密切相关的物理、化学测试项目,涉及产品 生物相容性可能发生改变的医疗器械,需进行生物学评价 。如适用,可采用包装完整性测试用于替代无菌测试 [ 2 ] 。 前 者则包括包装 封口 完整性、包装强度和微生物屏障性能等测试项目。 适用时,宜 提供方法学研究。其中,包装完整性测试项目包括染色液穿透法测定透气包装的密封泄漏试验、目力测试和气泡法测定软性包装泄漏试验等;包装强度测试项目包括软性屏障材料密封强度试验、无约束包装抗内压破坏试验和模拟运输试验等。
仅设置一个观察时间点,可能不能 及时 发现产品 失效 的时间, 建议注册申请人 在试验过程中设立多个测试 观察 时间点(一般不少于 3 个)测试。可采用零点时间性能数据作为测试项目的参照指标。末次观察点 宜至少 与 预期申报 货架有效期 时间 相同。 考虑到真实 世界 环境 变化的 复杂性 ,建议 设定 长于 预期申报 货架 有效期 的观察点。
3. 进行验证试验的产品
医疗器械货架有效期验证试验宜采用与常规生产相同的终产品进行 ,适宜项目(如包装 密封性 )可采用无产品的包装进行验证 。 如批次间 差异 可能影响货架有效期验证结果,则可考虑对适当 批次产品 进行验证。当注册 申请人 对产品及 包装 材料特性、灭菌过程等影响因素进行 充分 评估后,适宜时 也 可选用一批产品进行试验。 注册申请人 可对试验产品进行设计最差条件下的验证试验以保证试验产品可代表最恶劣的生产情况,如进行一个标准的灭菌周期后,附加一个或多个灭菌周期,或采用几种不同的灭菌方法。
4. 验证试验中采用的统计处理方法
注册申请人 宜在验证试验方案中设定每一测试项目的测试样品数量 。适用时 ,样本 数量宜 确保测试结果具有统计学意义,并在试验报告中提供相关信息。
(四)参考标准
建议医疗器械 注册申请人 尽可能采用国家标准、行业标准和公认的国际标准中规定的方法 / 措施对其医疗器械产品货架有效期进行验证,以减少验证结果的偏差,提高验证结论的准确性。附录中列举了可能在货架有效期验证过程中涉及的部分标准,但不仅限于所列内容。
(五)注册时应提交的技术文件
注册申请人在无源植入性医疗器械注册时需提供详细的货架有效期验证资料,一般包括以下内容:
1. 与申请注册产品货架有效期相关的基本信息。包括该医疗器械原材料 / 组件、包装材料、生产工艺、灭菌方法(如涉及)、货架有效期、储存运输条件等;
2. 注册申请人 在该医疗器械货架有效期验证过程中对相关影响因素的评估报告;
3. 如 采用实时稳定性试验 验证 货架有效期, 宜 提交试验方案及试验报告,同时提供试验方案中 试验 条件 、 测试项目、测试判定标准、测试时间点 、 测试 批次及 样本量的确定依据和相关研究资料;
4. 注册 申报时, 经分析如可 采用 加速稳定性 实验 验证 货架有效期, 则 提供加速稳定性试验的试验方案和试验报告 及 实时稳定性实验的实验方案 。 同时提供试验方案中 试验 条件、测试项目、测试判定标准、加速老化参数、测试时间点 、 测试 批次 及样本量的确定依据和相关研究资料 。
5. 包装工艺验证报告及包装、密封设备的详述;
6. 注册申请人 认为宜在注册时提交的其他相关支持性资料。
注册申请人 可在申请注册产品的货架有效期技术文件中使用其生产的其他医疗器械产品的货架有效期研究资料及验证资料,但宜同时提供二者在原材料、包装材料、生产工艺、灭菌方法(如涉及)等与货架有效期相关的信息对比资料和二者在货架有效期方面具有等同性的论证资料。
四、名词解释
货 架有效期( Shelf Life ) :指医疗器械 以终产品 形式储存,能够发挥拟定作用的时间段。货架有效期的终点是产品失效日期。超过此期限后,医疗器械产品将 可能不再具有预期的性能参数及功能。
植入性医疗器械( Implantable Medical Device ) :指借助手术全部或者部分进入人体内或腔道(口)中,或者用于替代人体上皮表面或眼表面,并且在手术过程结束后留在人体内 30 日(含)以上或者被人体吸收的医疗器械。(该定义不适用于有源植入性医疗器械)
批次 ( Lot or batch ) :是指由 相 同类型 、 型号 、 等级 、尺寸、材料成分 等 组成的一个或多个部件或最终器械 , 在相同条件下生产出来,并在规定条件下具有统一的特性和质量。
五、参考文献
1. Clark GS, Shelf Life of Medical Devices, FDA, April 1991
2. Container and Closure System Integrity Testing in Lieu of Sterility Testing as a Component of the Stability Protocol for Sterile Products, FDA, February 2008
3. Guidance Technical Files and Design Dossiers for Non Active Medical Devices, TDesign Dossiers forn Lieu of Sterility
4. 《化学药物稳定性研究技术指导原则》( 2005.3 )
5. 王春仁,许伟,医疗器械加速老化实验确定有效期的基本原理和方法,《中国医疗器械信息》 2008 年第 14 卷第 5 期
六、起草单位
国家药品监督管理局医疗器械技术审评中心
原文及意见表下载链接:https://www.cmde.org.cn/CL0004/23540.html
