UC 公开征求《高端医疗装备应用示范基地管理办法(试行)》意见
2022-07-13
来源
中华人民共和国工业和信息化部
作者
CIRS
为加快推进高端医疗装备发展应用,工业和信息化部、国家卫生健康委联合起草了《高端医疗装备应用示范基地管理办法(试行)》(征求意见稿),现面向社会公开征求意见。如有意见或建议,请于2022年8月10日前通过传真或电子邮件反馈。
联系方式:
工业和信息化部(装备工业一司)010-68205603
国家卫生健康委(规划司)010-68791230
传真:010-66013726
电子邮箱:shewzh@miit.gov.cn
附件:《高端医疗装备应用示范基地管理办法(试行)》(征求意见稿)
工业和信息化部装备工业一司
国家卫生健康委规划司
2022年7月8日
【附件】
高端医疗装备应用示范基地管理办法(试行)
(征求意见稿)
第一章 总 则
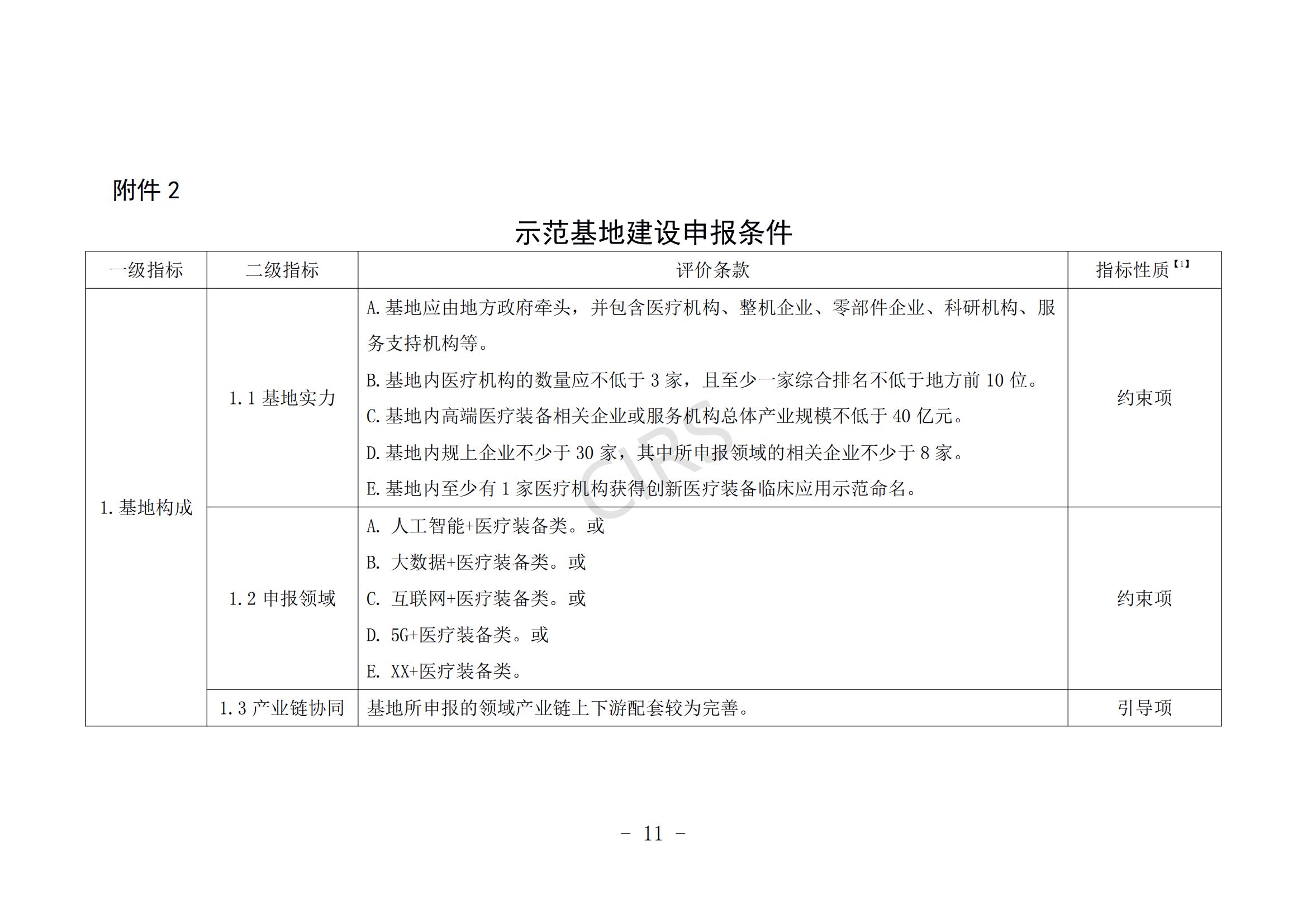
第一条 为贯彻落实习近平总书记关于加快补齐我国高端医疗装备短板的重要指示精神,按照全国评比达标表彰工作协调小组办公室《关于公布第二批全国创建示范活动保留项目目录的通告》要求,根据《“十四五”医疗装备产业发展规划》重点任务部署,推动医疗装备产业高质量发展,指导各地科学有序开展高端医疗装备应用示范基地(以下简称示范基地)建设,制定本办法。
第二条 本办法所称高端医疗装备是指产品性能达到国际先进或国内领先水平的医疗装备,产品类别主要包括诊断检验装备、治疗装备、监护与生命支持装备、中医诊疗装备、妇幼健康装备、保健康复装备、有源植介入器械等。
第三条 本办法所称示范基地是指以医疗装备作为优势产业,对医疗装备技术、产品、临床应用、服务模式及创新链、产业链、服务链优化升级具有示范带动作用,主导产品发展水平、规模效益、临床应用等居行业领先地位的医疗装备产业发展集聚区。
第四条 示范基地包括开展临床应用示范和示范基地建设两个部分,临床应用示范是示范基地建设的组成部分和前提条件。
临床应用示范 ,由知名医疗机构牵头会同区域内医疗资源,与龙头生产企业等合作开展新型产品诊疗技术及综合外科复合手术室UC研究,探索可复制、可推广的医产合作新模式,对推动创新医疗装备发展应用具有较强的示范带动作用。
示范基地建设 ,由地方政府牵头组织知名医疗机构、科研机构、生产企业、检测机构等合作,探索建立健全医疗装备从技术开发、产品生产、示范验证到应用推广的创新体系,营造包括政策、金融、监管、学科交叉、医疗示范等于一体的激励产业创新发展的生态环境,形成主导产品特色鲜明、创新要素高度集聚、网络协作紧密高效、产业生态体系完善的医疗装备制造业集聚区。
第五条 工业和信息化部、国家卫生健康委负责示范基地的评审及相关管理工作。省级工业和信息化主管部门会同同级卫生健康主管部门负责组织本地区示范基地的申报、初审、推荐和日常监督管理等工作,并配合工业和信息化部、国家卫生健康委指导各地规范开展临床应用示范、示范基地建设。
第二章 申报与评审
第六条 申报主体。
(一)临床应用示范由医疗机构牵头,采取“1+N+N”联合体方式申报,即 1 家牵头医疗机构+N 家医疗装备企业+N家联合医疗机构。
(二)示范基地建设由地方政府(地市级及以下,含产业园区、经济技术开发区、高新技术开发区等)牵头申报,组织医疗机构、医疗装备企业、科研机构等开展合作。
第七条 临床应用示范申报条件。
(一)申报单位具备一定的基础实力,拥有较强的行业引领地位。
(二)联合体具备较强的创新医疗装备研发生产、检验验证、改进优化、临床评价、推广应用、知识产权保护运用等能力。
(三)联合体具有较为完善的临床研究管理体系和临床研究资金保障。
(四)创新医疗装备产品或UC的关键材料、零部件(元器件)、关键技术基本安全可控。
(五)所申报领域的医疗装备产品或UC在申报单位临床应用数量占有一定比例,且应符合《医疗器械监督管理条例》《医疗技术临床应用管理办法》等有关规定要求。
(六)近 3 年内未发生过重大产品(服务)质量事故。
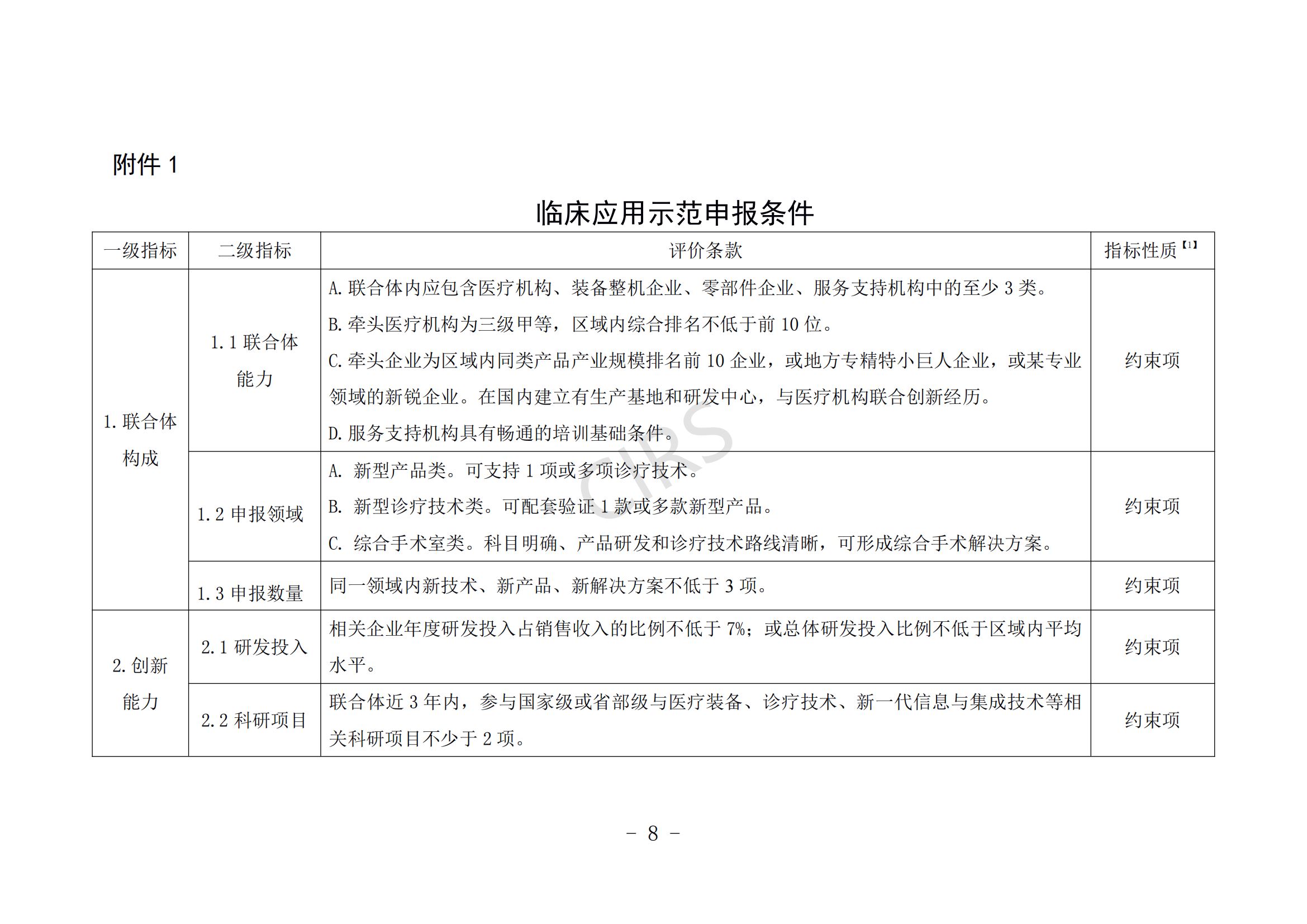
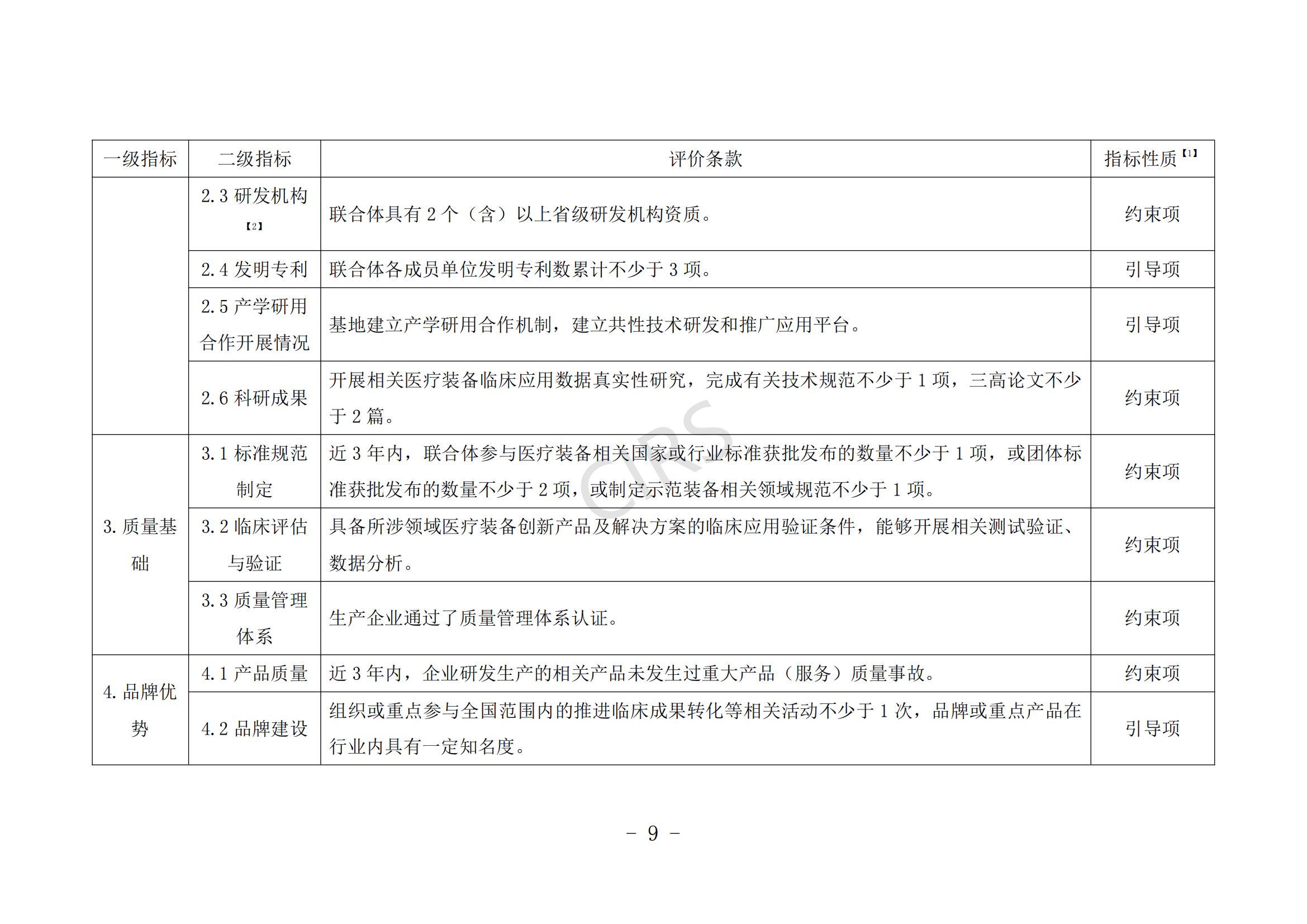
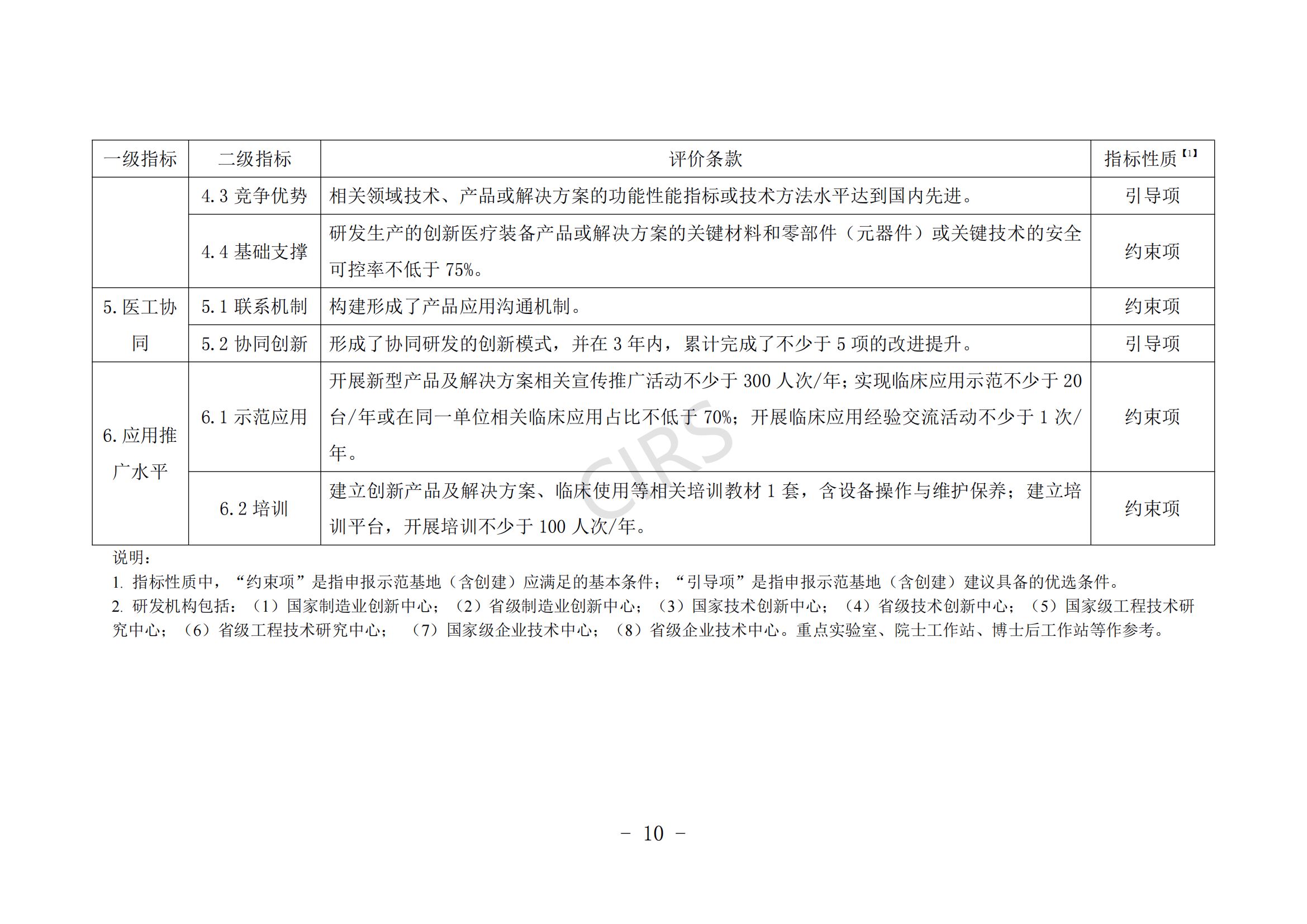
申报条件具体要求见附件 1。
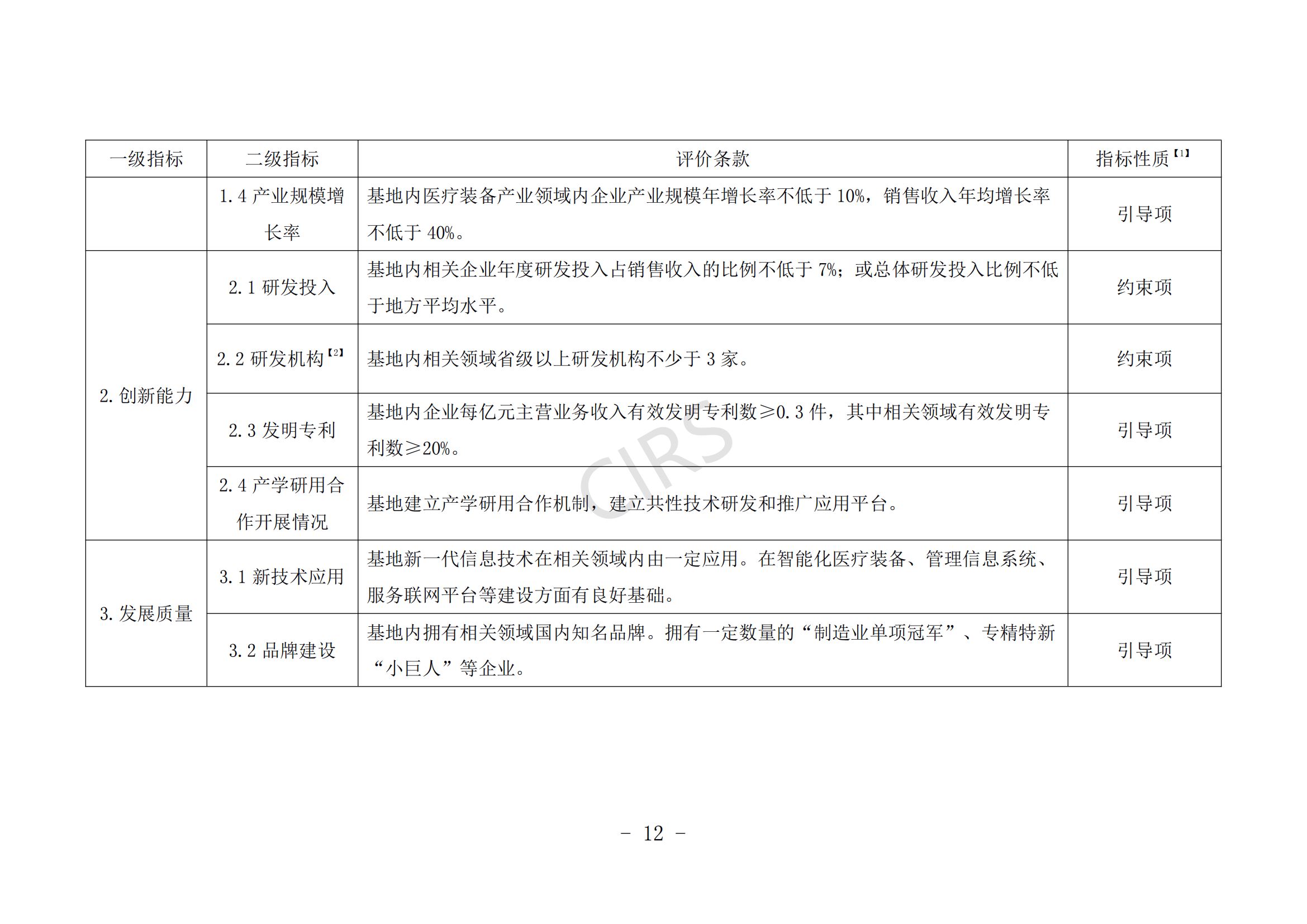
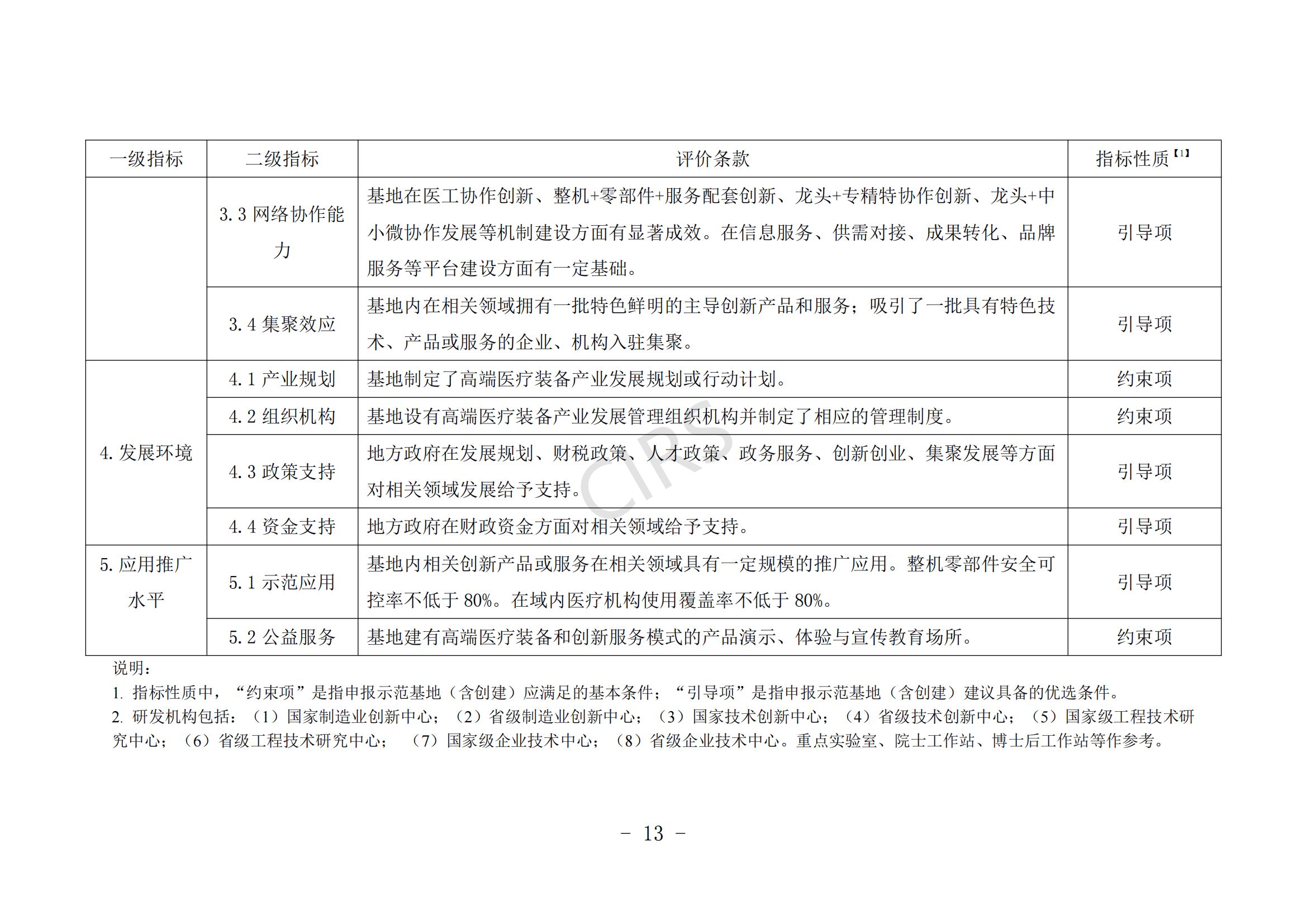
第八条 示范基地建设申报条件。
(一)申报主体应在产业链培育、产业集聚效应、产业生态体系建设等方面具有一定优势。
(二)申报主体具有新一代信息技术与医疗装备产业融合发展能力,具备智能化医疗装备、管理信息系统、医疗装备注册认证服务、知识产权保护运用等公共服务平台方面的建设基础。
(三)申报主体在发展规划、财税政策、人才政策、创新创业、集聚发展、审评审批、医保服务等方面对医疗装备发展有明确的保障措施。
(四)近 3 年内未发生过重大产品(服务)质量事故。
(五)支持医疗机构开展创新医疗装备临床研究,所在地有 1 家及以上医疗机构成功开展创新医疗装备的临床应用示范。
申报条件具体要求见附件 2。
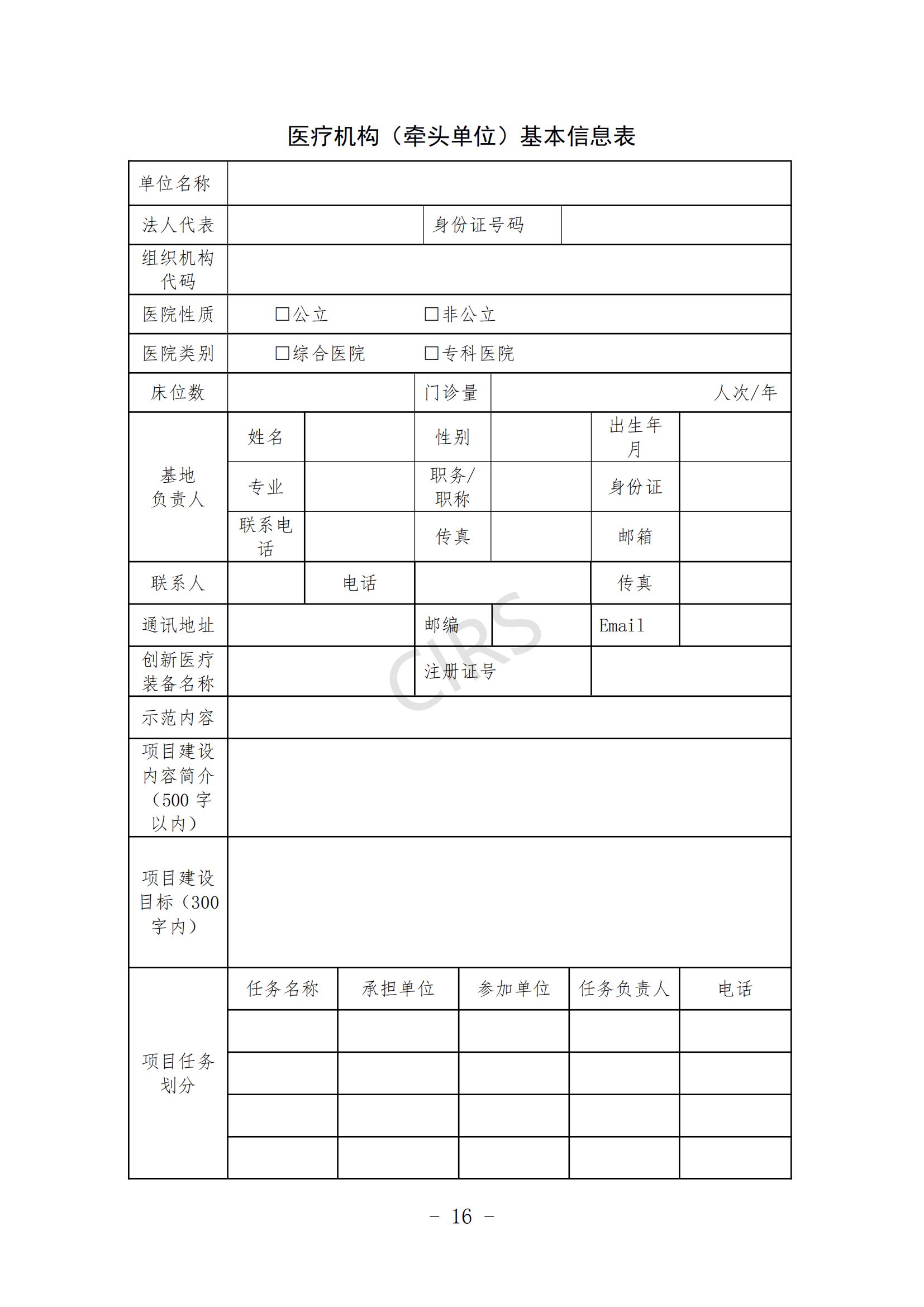
第九条 申报材料。
(一)申报书(见附件 3、附件 4)。
(二)省级工业和信息化主管部门、卫生健康主管部门书面推荐意见。
第十条 申报流程。
(一)工业和信息化部、国家卫生健康委定期组织开展临床应用示范、示范基地建设的遴选和评审工作。临床应用示范、示范基地建设分年度组织。
(二)申报主体结合自身情况自愿申请,按要求准备申报书及相关材料,提交至牵头单位所在地省级工业和信息化主管部门、卫生健康主管部门。
(三)牵头单位所在地省级工业和信息化主管部门会同同级卫生健康主管部门对申报材料开展审查,联合出具书面推荐意见,并将相关申报材料各一式两份分别报送至工业和信息化部(装备工业一司)、国家卫生健康委(规划司)。
第十一条 评审。
(一)临床应用示范评审。
工业和信息化部会同国家卫生健康委组织专家对申报材料进行评审。评审结果在工业和信息化部、国家卫生健康委门户网站公示 10 个工作日。
(二)示范基地建设评审。
工业和信息化部会同国家卫生健康委组织专家对申报单位进行现场考察和答辩评审。评审结果在工业和信息化部、国家卫生健康委门户网站公示 10 个工作日。
第十二条 命名。
(一)临床应用示范。
通过评审且公示期无异议的临床应用示范,由工业和信息化部、国家卫生健康委联合命名为高端医疗装备应用示范基地(临床应用示范:具体示范产品类别),命名有效期限为 3 年。
(二)示范基地建设。
通过评审且经公示无异议的示范基地建设,由工业和信息化部、国家卫生健康委联合命名为高端医疗装备应用示范基地(主导产品类别)。
第三章 管理
第十三条 工业和信息化部、国家卫生健康委指导推荐单位加强对临床应用示范的日常指导和监督管理,不定期组织专家对临床应用示范推进情况开展检查评估,对于评估不通过的,取消命名。
第十四条 工业和信息化部、国家卫生健康委对示范基地实施动态管理。每年 3 月底前,示范基地应将上一年度工作总结和本年度工作计划报至推荐单位。推荐单位核实汇总后,分别报工业和信息化部(装备工业一司)、国家卫生健康委(规划司)。对于连续两年未按规定报送年度工作总结和计划的,撤销命名。撤销命名前将告知有关单位,听取其陈述和申辩。
第十五条 对申报单位存在提供虚假材料骗取评审、称号命名等严重违法违规行为的,一经发现将取消命名资格。3 年内不得重新申报示范基地。
第十六条 对于出现重大安全、质量事故或违法违规违纪等行为的临床应用示范或示范基地建设,将撤销其命名,并移交相关部门按程序处理。撤销命名前将告知有关单位,听取其陈述和申辩。
第十七条 工业和信息化部、国家卫生健康委对示范成果推广应用和示范基地建设予以支持。根据实际情况在产学研检用金合作、技术推广、标准制定、项目推荐、交流合作等方面对于重点指导和支持。对具有显著临床应用价值的创新医疗装备,优先推荐至优秀医疗设备目录等;对符合条件的首台(套)高端医疗装备,优先推荐至《首台(套)重大技术装备推广应用指导目录》。
第四章
附 则
第十八条 本办法由工业和信息化部、国家卫生健康委负责解释。
第十九条 本办法自 2022 年 月 日起施行。
扫描下方的二维码订阅“
CIRS医械合规动态
”! 实时传递最新医疗器械监管法规动态,分享医疗器械注册成功经验及经典案例跟踪医疗器械最新产品安全与法规监管动态,获得最新一手资讯。
① 凡本网注明"稿件来源:“杭州瑞旭科技集团有限公司"的所有文字、图片和音视频稿件,版权均属杭州瑞旭科技集团有限公司所有,任何媒体、网站或个人未经本网协议授权不得转载、链接、转贴或以其他方式复制发表。已经本网协议授权的媒体、网站,在下载使用时必须注明"稿件来源:杭州瑞旭科技集团有限公司",违者本网将依法追究责任。
② 本网未注明"稿件来源:杭州瑞旭科技集团有限公司 "的文/图等稿件均为转载稿,本网转载出于传递更多信息之目的,并不意味着赞同其观点或证实其内容的真实性。如其他媒体、网站或个人从本网下载使用,必须保留本网注明的"稿件来源",并自负版权等法律责任。如擅自篡改为"稿件来源:杭州瑞旭科技集团有限公司",本网将依法追究责任。如对稿件内容有疑议,请及时与UC联系。
③ 如本网转载稿涉及版权等问题,请作者在两周内速来电或来函与杭州瑞旭科技集团有限公司联系。