作为国际公认的一类重量级营养元素,2023年,我国实现了母乳低聚糖(HMOs)在法规上的突破:2’-岩藻糖基乳糖(2’-FL)和乳糖-N-新四糖(LNnT)正式被批准为食品营养强化剂新品种。之后,仍有多个HMOs走在合规道路中:2024年5月10日,CFSA最新发布的公开征求意见稿中,又出现了2’-FL和LNnT的身影。
中国HMOs法规进程加快、申报热度持续高涨
HMOs的主要几类物质在中国均有合规进度,其中2’-FL热度最高。为帮助各企业掌握其最新进度,瑞旭集团特对2’-FL在我国的报批情况进行汇总。截止2024年5月10日:
- 已获批的2’-FL(4款):微生物发酵法,标准相同、生产菌信息各不同;
- 已公开征求意见、尚未获批的2’-FL(5款):包括1款合成法和4款微生物发酵法,除生产菌信息外执行公告,其中最新征求意见的1款产品生产菌信息与已获批公告完全一致;
- 已受理、尚在技术审评中的2’-FL(12款):包括7款延期1款受理4款不予行政许可产品。
详细信息请参见下文:
|
营养强化剂 |
来源 |
供体 |
公告 |
|
2’-岩藻糖基乳糖 2’-fucosyllactose |
大肠杆菌 K-12 DH1 MDO E. coli K-12 DH1 MDO |
螺杆菌 (Helicobacter spp.) a |
2023年10月7日 2023年 第8号 |
|
大肠杆菌K-12 MG1655 E. coli K-12 MG1655 |
螺杆菌 (Helicobacter spp.) a |
||
|
大肠杆菌 BL21(DE3) E. coli BL21(DE3) |
奈瑟菌 (Neisseria spp.) a |
||
|
大肠杆菌 BL21(DE3) Escherichia coli BL21(DE3) |
幽门螺杆菌 (Helicobacter pylori) a |
2024年3月13日2024年 第2号 |
a为α-1,2-岩藻糖基转移酶供体
公开征求意见的2’-FL(5款)
|
序号 |
公开征求时间 |
备注 |
|
1 |
2021年10月21日 |
合成法 |
|
2 |
2023年08月23日 |
微生物发酵法。生产菌信息: 来源:谷氨酸棒状杆菌 ATCC 13032; 供体:盐渍假杆菌(Pseudopedobacter saltans)a |
|
3 |
2024年03月13日 |
微生物发酵法。生产菌信息: 来源:大肠杆菌BL21 star(DE3); 供体:大肠杆菌O126 a |
|
4 |
2024年05月10日 |
微生物发酵法。生产菌信息: 来源:大肠杆菌K-12 GI724; 供体:普通拟杆菌(Bacteroides vulgatus) a |
|
5 |
2024年05月10日 |
微生物发酵法。生产菌信息: 来源:大肠杆菌K-12 MG1655; 供体:螺杆菌(Helicobacter spp.) a 注:与2023年第8号生产菌公告信息一致 |
a为α-1,2-岩藻糖基转移酶供体
处于受理及资料补充阶段2’-FL(共12款)
|
序号 |
受理信息(时间/受理编号) |
审评信息/状态 |
|
1 |
2023/07/14 卫食添新申字(2023)第0045号 |
2024/03/07 延期通知书信息送达 |
|
2 |
2023/09/20 卫食添新申字(2023)第0061号 |
2024/04/15 延期通知书信息送达 |
|
3 |
2023/11/01 卫食添新申字(2023)第0065号 |
2023/12/12 延期通知书信息送达 |
|
4 |
2023/11/21 卫食添新申字(2023)第0074号 |
2023/12/12 延期通知书信息送达 |
|
5 |
2024/01/11 卫食添新申字(2024)第0002号 |
2024/04/15 延期通知书信息送达 |
|
6 |
2024/01/16 卫食添新申字(2024)第0005号 |
2024/02/08 延期通知书信息送达 |
|
7 |
2024/01/18 卫食添新申字(2024)第0009号 |
2024/02/08 延期通知书信息送达 |
|
8 |
2021/05/07 卫食添新申字(2024)第0042号 |
/ |
|
9 |
2023/11/30 卫食添新申字(2023)第0076号 |
2024/02/08 不予行政许可 |
|
10 |
2023/11/01 卫食添新申字(2023)第0064号 |
2024/02/08 不予行政许可 |
|
11 |
2023/09/19 卫食添新申字(2023)第0058号 |
2024/02/08 不予行政许可 |
|
12 |
2022/11/15 卫食添新申字(2022)第0085号 |
2024/03/25 不予行政许可 |
数据源于卫健委政务大厅信息公示栏
由上统计可以看出:2023年2’-FL正式获批后,很多企业还是不断提交新的申请并被受理,申报热情高涨。其实不仅仅是2’-FL,HMOs中的其他几类典型物质都有不仅一次的受理记录。
即使产品信息符合获批公告,也需要当做“新品种”申报。
相信很多企业和相关人士会产生疑问:为何它们会有如此多的报批申请呢?符合公告的产品还需要再次申报吗?答案是:【需要的】。接下来,瑞旭集团会从两方面展开分析。
食用安全
国际上已批准使用的、包括我国目前获批的HMOs主要采用基因工程菌发酵制备。在中国该类添加剂新品种申报流程较为复杂,需要经过两个监管部门的评估或审批。
(1)农业农村部,负责生产添加剂的工程菌的安全性评估工作;
(2)国家卫健委,负责发酵终产品,即食品添加剂新品种的审批工作。
对于转基因微生物(即生产菌),可能其来源、供体与公告一致,但各企业的基因工程技术操作、产物合成途径不可能完全相同,因此从食品安全角度和其工艺的特殊性,这类物质都需要农业农村部和国家卫健委的“个案审批”。
公告法规
以2’-FL的公告和最新公开征求意见稿内容为例,值得关注的有两处:
- 生产菌需要经过安全性评估(瑞旭说明:仅满足公告不行,仍需通过相关监管部门的评估)。

(图源2023年 第8号公告)
- 最新发布的2’-FL公开征求意见稿中,生产菌信息完全符合之前的公告。(瑞旭说明:即使生产菌符合公告且通过安全性评估,仍需进行添加剂申报、并向公众发布征求意见稿)
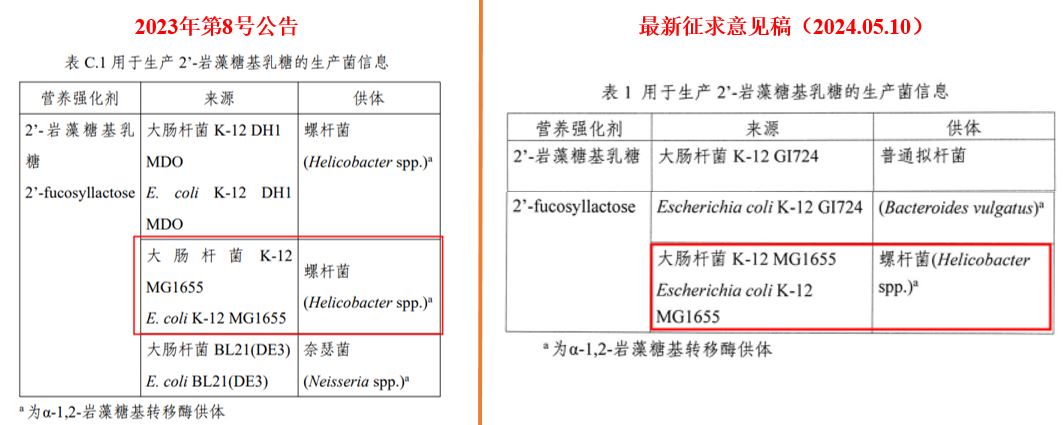
同时,瑞旭集团与监管部门和多方专家确认,对于利用合成生物技术生产的食品配料,如HMOs物质:即使生产菌信息能够满足公告要求,仍需通过农业农村部对生产菌的安全性评估、并且向卫健委提请食品添加剂新品种的申报审评。
此外,提醒此类原料的使用方,合规采购有资质的原料是保证终产品安全的重要因素。
HMOs一经合规,在中国应用市场势头正旺,相信未来几年内会维持法规申报获批和营养创新研发领域的热度。瑞旭集团会一直关注这类物质的审批动态和政策变化!
关于瑞旭
瑞旭集团食品事业部组建于2012年,已经帮助超过1000家国内外食品及相关企业完成“一站式”的食品合规工作。在三新食品、合成生物学食品、美国GRAS、保健食品、两特食品等申报领域拥有众多成功案例。目前,瑞旭集团已代理数十款转基因微生物食品添加剂申报,项目经验按成功案例位于行业前列。欢迎垂询或拜访进一步了解UC的技术实力!
