在保健食品注册新规实施的背景下,为规范原卫生部等过去不同时期批准的“无有效期、无产品技术要求”(以下简称“双无”)保健食品注册证书,市场监管总局于2023年12月27日发布《在产在售“双无”保健食品集中换证审查要点(征求意见稿)》,并公开征求意见,截止时间为2024年1月26日。
根据瑞旭集团此前的统计,已获批准的“双无”产品数量接近万数,换证规模庞大。本文旨在对集中换证的大体流程、要点等进行梳理和解读,助力企业顺利完成新规下的产品换证工作。
-
换证范围
过渡期内(自2023年8月31日起5年内),持有效生产许可的“双无”产品。
-
换证程序及要求
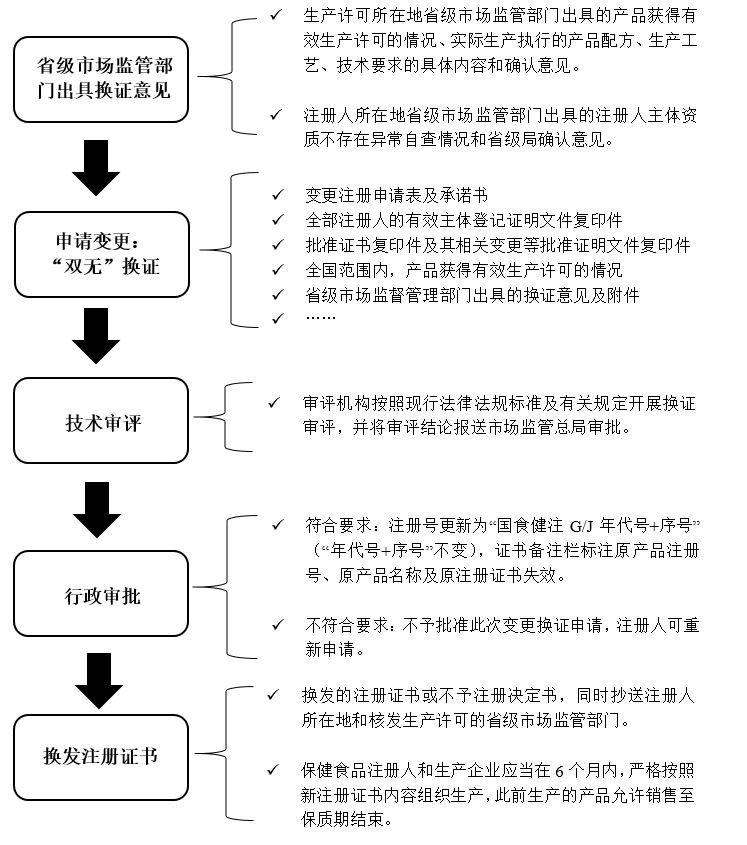
-
要点关注
(1)关于品名:产品名称应当符合现行规定。保留产品名称理由合理的,允许保留原产品名称。
(2)除了八类功能需要重(补)做功能学试验,征求意见稿中涉及检测的其他情形:
|
情形 |
要求 |
|
原料无使用依据或原料用量超出现行规定 |
按现行规定调整配方(含替换原料),按新产品注册重新开展毒理、功能、卫生学、稳定性等验证试验 |
|
配方含有保健食品新原料,原注册时未提供原料安全性评价材料 |
按照《保健食品及其原料安全性毒理学检验与评价技术指导原则(2020年版)》有关要求进行新原料及产品的安全性评价和关联审查 |
|
配方含有2个及以上保健食品新原料,原注册时未提供原料安全性评价材料 |
按照《保健食品及其原料安全性毒理学检验与评价技术指导原则(2020年版)》对每个新原料及产品进行急性经口毒性试验、三项遗传毒性试验、90天经口毒性试验和致畸试验,以及新原料与产品的关联审查 |
|
产品技术要求涉及增订、修订质控指标 |
提交修订说明以及相应的卫生学、稳定性、功效成分/标志性成分检验报告等资料 |
|
产品技术要求涉及增订功效成分/标志性成分指标,以及理化指标检测方法为注册人自行研究制定 |
提供检测方法学验证等相关研究资料 |
|
对原料质量标准等内容进行调整,涉及产品物质基础实质性改变 |
按照新产品要求重新开展毒理、功能、卫生学、稳定性、功效成分/标志性成分等验证试验 |
(3)关于进口保健食品:免于提供“生产许可所在地省级市场监督管理部门出具的换证意见”,按要求提供资质证明文件等其他材料。
-
瑞旭观点
据相关部门统计,获得生产许可的“双无”保健食品约1800款,过渡期内,市场监管总局的换证工作将以这些产品为重点开展。建议有换证需求且产品在产在售的企业按照征求意见稿中的要求,提前准备相关材料,争取在过渡期内完成换证工作。未持有效生产许可的“双无”产品,获得生产许可后,可按程序提出换证申请。
-
官方公告:
市场监管总局关于公开征求《在产在售“双无”保健食品集中换证审查要点(征求意见稿)》意见的公告
作者:章淑寅
