1、消毒产品介绍
消毒产品定义: 指专门用于杀灭和清除传播媒介上的病原微生物,以化学、物理或生物方式预防控制感染性疾病或传染性疾病的一类特殊的健康相关产品。
作用方式: 化学、物理、生物方式杀灭或清除病原微生物。
使用场所: 人体外部环境:医疗器械、皮肤、黏膜、餐饮具、瓜果蔬菜、水、环境、物体表面、空气、污物等。
防治对象:病原微生物,包括金黄色葡萄球菌、大肠杆菌、白色念珠菌、铜绿假单胞菌、细菌芽胞、龟分枝杆菌、白色葡萄球菌、黑曲霉菌、脊髓灰质炎病毒等。
消毒产品类别:
- 消毒剂(含氯消毒剂、过氧化物类消毒剂、醛类消毒剂、醇类消毒剂、含碘消毒剂、酚类消毒剂、环氧乙烷、双胍类消毒剂和季铵盐类消毒剂);
- 消毒器械(包括生物指示剂、化学指示剂及灭菌包装物);
- 卫生用品(一次性卫生用品+抗抑菌制剂)。
风险等级:
- 第 I 类:较高风险,需严格管理以保证安全、有效的消毒产品(包括用于医疗器械的高水平消毒剂和消毒器械、灭菌剂和灭菌器械,皮肤、黏膜消毒剂,生物指示物、灭菌效果化学指示物等);
- 第 II 类:中度风险,需要加强管理以保证安全、有效的消毒产品(包括除第一类产品外的消毒剂、消毒器械、化学指示物,以及带有灭菌标识的灭菌物品包装物、抗(抑)菌制剂等);
- 第 III 类:风险程度较低,实行常规管理可以保证安全、有效的除抗(抑)菌制剂外的卫生用品(是除抗(抑)菌制剂外的卫生用品,如妇女经期卫生用品、尿布等排泄物卫生用品、其他的一次性卫生用品等)。
2、消毒产品监管
监管部门
|
国家卫健委 |
各地卫生监督机构 |
市 场监督局 |
标委会 |
海关及CIQ |
CDC |
应急管理部 |
|
负责全国消毒产品监督管理工作 |
负责本辖区消毒产品的审批、备案以及监督抽检工作 |
上市消毒产品展开抽查、消毒产品营业执照颁发 |
消毒产品标准立项、制定、审查和发布 |
进出口消毒产品检验检疫及关税征收 |
新消毒产品的技术评审并负责组织制定国家公共卫生技术方案和指南 |
危险化学品生产许可、经营许可、登记等 |
法律法规
- 《中华人民共和国传染病防治法》
- 《消毒管理办法》
- 《消毒产品分类目录》
- 《消毒技术规范》
- 《消毒产品卫生安全评价规定》
- 《消毒产品生产企业卫生规范》
- 《消毒产品卫生安全评价技术要求》
- 消毒产品相关卫生标准
消毒产品生产企业的卫生监督内容
当地卫生监督部门或机构主要对消毒产品生产企业进行以下卫生监督:
- 消毒产品及生产企业卫生许可资质,在国内从事消毒产品生产、分装的单位和个人,必须按照相关规定要求申领消毒产品生产企业卫生许可证一企一生产场所一证,一个集团或公司拥有多个生产场所的,应分别申请卫生许可证。企业生产列入《危险化学品目录》中的消毒产品成品或者中间产品, 还应依照规定取得危险化学品安全生产许可证;
- 生产条件(生产皮肤黏膜消毒剂&抗抑菌制剂&卫生用品需要净化车间、生产戊二醛车间需通风设施、生产乙醇车间需防爆设施),生产过程(是否执行标准操作规程和管理制度,是否添加国家规定禁用的物质);
- 使用原材料卫生质量;
- 消毒产品和物料仓储条件;
- 消毒产品从业人员配备和管理情况;
- 消毒产品卫生质量:出厂检验;
- 卫生安全评价报告+说明书标签。
3、消毒产品卫生安全评价
2014年,为进一步深化卫生行政审批制度改革,规范消毒产品的生产经营行为,保障用于传染病防治的消毒产品的有效性、安全性,依据《中华人民共和国传染病防治法》、《消毒管理办法》和有关规定,制定了《消毒产品卫生安全评价规定》,后又在2018年发布WS 628-2018《消毒产品卫生安全评价技术要求》,其中提出产品责任单位在第一类和第二类(消毒剂、消毒器械、抗抑菌制剂)消毒产品首次上市前需要对产品有效性和卫生安全性进行综合评价,形成《消毒产品卫生安全评价报告》,并对评价结果负责。消毒产品责任单位在第一类和第二类消毒产品首次上市前需要进行卫生安全评价,可将有关卫生安全评价报告录入全国信息服务平台进行备案。
全国信息服务平台于2018年10月8日上线运行,主要是为全国消毒产品责任单位提供消毒产品卫生安全评价网上备案服务,为社会监督和信息查询、社会信用体系建设、监督机构开展事中事后监督执法提供规范统一的信息服务,网址为:点击查看
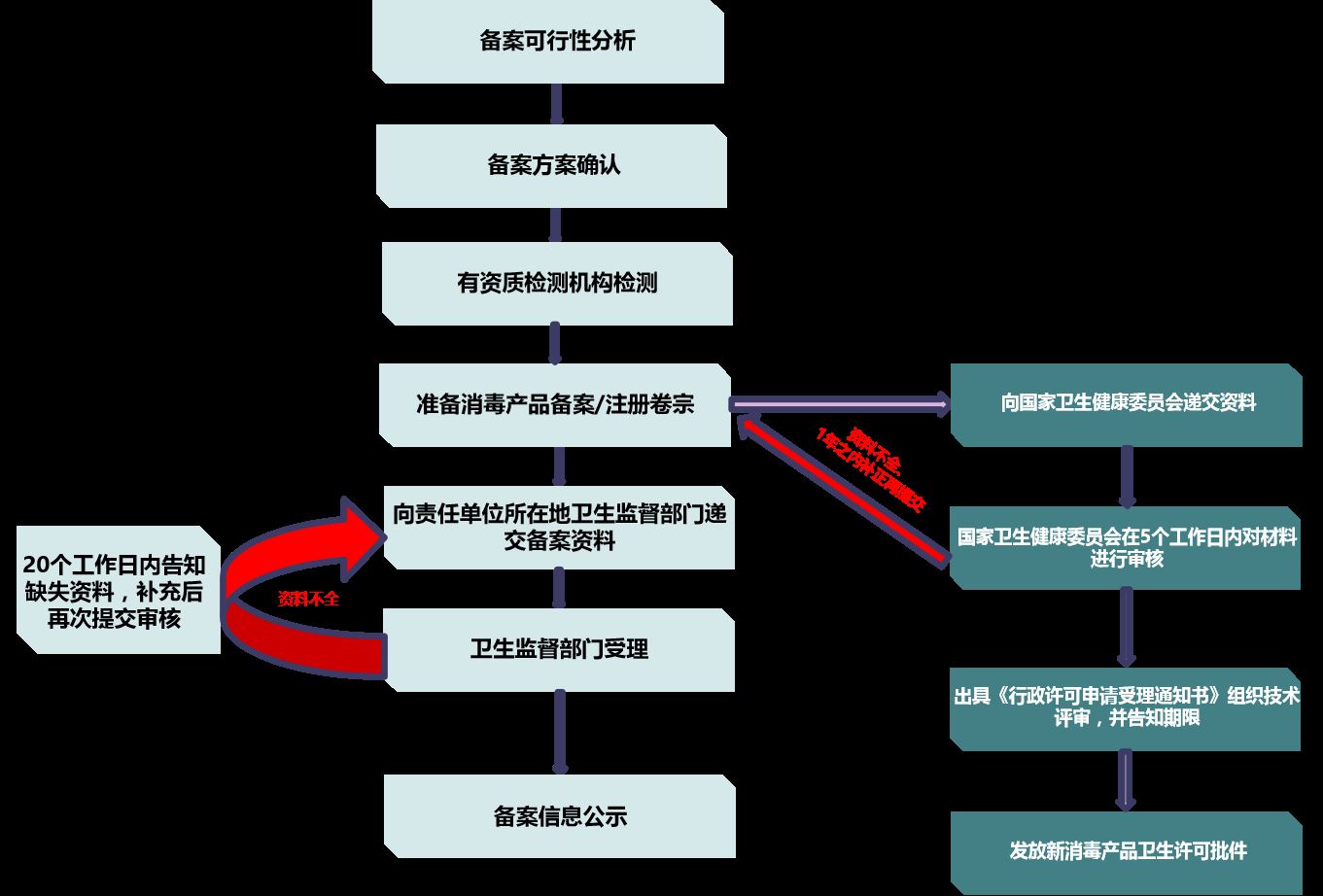
消毒产品安全评价&备案流程
消毒产品卫生安全评价备案,需准备以下资料:
- 封面;
- 备案登记表、安全评价基本情况表;
- 市售标签(铭牌)、市售说明书;
- 检验报告(含结论);
- 国产产品备案企业标准或进口产品质量标准;
- 国产产品生产企业卫生许可证;
- 进口产品生产国(地区)允许生产销售的证明文件(公证)及报关单;
- 进口产品在华责任单位授权书(公证);
- 消毒剂、抗(抑)菌制剂产品配方;
- 消毒器械元器件、结构图;
- 其他(产品照片、委托加工合同、商标文件等)。
检测要求(有CMA资质)
|
检测项目 |
检测内容 |
|
理化试验 |
有效成分含量检测、pH值、稳定性、Pb、As、Hg、金属腐蚀性 |
|
毒理学试验 |
急性经口毒理试验、一(多)次完整皮肤刺激试验、眼刺激试验、致突变试验 |
|
功效试验 |
微生物杀灭试验、微生物抑菌试验、(模拟)现场试验 |
|
其他 |
微生物污染指标(GB 27951)、微生物指标(GB 15979) |
消毒产品标签说明书通用要求
国家卫生健康委员会等相关部门制定了强制性卫生标准—GB 38598-2020 《消毒产品标签说明书通用要求》,对标签说明书要求作进一步的补充和完善,该标准于2020年11月17日发布,2021年12月1日实施。
该标准对消毒产品的标签说明书内容列出各项要求,以消毒剂、抗(抑)菌制剂为例,在申请消毒备案时要注意标签说明书内容的以下几点:
消毒剂
|
定义 |
用于杀灭传播媒介上的微生物使其达到消毒或灭菌要求的制剂 |
|
最小销售包装特别注意事项 |
使用范围(用于黏膜的消毒剂应标注“仅限医疗卫生机构诊疗用”内容) |
|
标签、说明书不应标注内容 |
a) 抗炎、消炎、治疗疾病、减轻或缓解疾病临床症状、描述或解释疾病症状、预防性病、杀精子、避孕; b) 用于人体足部、眼睛、指甲、腋部、头皮、头发、鼻黏膜、肛肠部位; c) X天为一疗程,或遵医嘱;防止复发;有利于伤口愈合;辅助配合药物治疗。 |
|
产品名称示例 |
XX®皮肤黏膜消毒液;XXTM戊二醛消毒液;XX牌三氯异氰尿酸消毒片;XX®碘伏消毒液;XX牌消毒液(多用途或多种有效杀菌成分的) |
抗(抑)菌制剂
|
定义 |
抗菌制剂:直接接触人体完整皮肤或黏膜的,具有一定杀菌作用的制剂 |
|
抑菌制剂:直接接触人体完整皮肤或黏膜的,具有一定抑菌作用的制剂 |
|
|
最小销售包装特别注意事项 |
抗(抑)菌制剂还应标注有效成分及其含量、使用范围(用于阴部黏膜的应标注“不应用于性生活中对疾病的预防”) |
|
标签、说明书不应标注内容 |
d) 抗炎、消炎、治疗疾病、减轻或缓解疾病症状预防性病; e) 适用于破损皮肤、破损黏膜、伤口等; f) 高效、消毒、灭菌、除菌、杀精子、避孕; g) 用于人体足部、眼睛、指甲、腋部、头发、头皮、鼻黏膜、肛肠部位; h) X天为一疗程,或遵医嘱;防止复发;有利于伤口愈合;辅助配合药物治疗。 |
|
产品名称示例 |
XX牌抗菌洗手液;XX®口腔抑菌喷剂 |
4、消毒产品进出口法规要求
法律法规
- 《进出口商品检验法》及其实施条例
- 《危险化学品安全管理条例》(国务院令第591号)
- 其他法律法规(《反恐怖主义法》等)
- 《关于进出口危险化学品及其他包装检验监管有关问题的公告》(质检总局2012年第30号公告)
- 地方政府相关条例(《上海市危险化学品安全管理办法》等)
受理主体
- 进口:进口化学品的收货人或者其代理人
- 出口:出口化学品的收货人或者其代理人
检验范围
- 列入国家《危险化学品名录》内的进口危险化学品实施检验监管
- 列入法定检验目录内的进出口化学品(医用消毒剂)
消毒产品进口要求
- 确定产品在华责任单位;
- 进行卫生安全评价&备案(I类、II类消毒产品),检测(III类消毒产品);
- 符合消毒产品标签,SDS和GHS标签;
- 确定HS code(380894项下);
- 按要求提供报检材料;
- 进口商进行危险化学品登记、危险化学品经营许可证;
- 国内运输合规。
进出口报检材料
- 进口危险化学品经营企业符合性声明;
- 出口危险化学品生产企业符合性声明;
- 《出境危险货物包装容器性能检验结果单》(散装货物除外);
- 危险特性分类鉴别报告;
- 中文安全数据单、中文危险公示标签样本;
- 对需要添加抑制剂或稳定剂的产品,应提供实际添加抑制剂或稳定剂的名称、数量等情况说明;
- 出口属于危险货物的消毒剂的生产企业还应向所在地海关申请出口危险货物包装使用鉴定。
属于危险化学品、危险货物的消毒剂
- 醇类消毒产品(乙醇(体积比>24%)消毒凝胶、异丙醇消毒液、酒精湿巾);
- 氧化剂类消毒产品(含有次氯酸钠、次氯酸的消毒产品、过氧乙酸(含量>8%));
- 季铵盐类消毒剂(高浓度季铵盐(含量>5%)危险货物);
- 复合碘产品。
危险货物在中国的运输
危险货物在中国运输,如采用不同的运输方式,按照不同的标准执行。
|
公路 |
《道路危险货物运输管理规定》 |
|
空运 |
《民用航空危险物品运输》 |
|
铁路 |
《铁路危险货物运输安全监督管理规定》 |
|
海运 |
参照IMDG操作 |
|
内河 |
《中华人民共和国内河交通安全管理条例》 |
少量危险化学品在中国运输
“危险化学品”禁止普通快递运输:
根据危险化学品安全管理条例-2011,第六十四条:任何单位和个人不得交寄危险化学品或者在邮件、快件内夹带危险化学品,不得将危险化学品匿报或者谎报为普通物品交寄。邮政企业、快递企业不得收寄危险化学品。
例外数量(EQ)&有限数量(LQ):是指危险货物在移交运输时,如数量较少,且包装满足一定要求,即可免除运输时的部分合规要求(例如,承运人资质,包装性能测试)。
参考法规:《危险货物道路运输规则》(JT/T617-2018);GB28644.1-2012 危险货物例外数量和包装要求;GB28644.2-2012 危险货物有限数量和包装要求;危险货物道路运输安全管理办法。
危险货物–例外数量和有限数量运输
危险货物必须是包装类Ⅱ或Ⅲ;包装类Ⅰ的危险货物不得限量;必须利用组合包装(内包装置于外包装之内)。
|
联合国编号 |
中文名称和说明 |
英文名称和说明 |
类别或项别 |
包装类别 |
有限数量 |
|
1212 |
异丁醇 |
ISOBUTANOL |
3 |
III |
5L |
|
1219 |
异丙醇 |
ISOPROPANOL |
3 |
II |
1L |
|
1230 |
乙醇 |
METHANOL |
3 |
II |
1L |
限量的原则是把大包件分解成小包件,然后将小包件置于外包装内。双层包装保护产品和可能的小渗漏。包括:吸附材料、衬垫等保护内容器的部件。
消毒抑菌产品及驱蚊产品受不同的法规管理,对于产品配方、安全测试、标签、登记备案和委托加工都有自己独特的监管要求。
瑞旭集团将于 4月12日 举办线上法规培训课《中国消毒抑菌产品及驱蚊产品合规培训》,诚邀您参加。本次培训免费,将帮您了解消毒抑菌产品及驱蚊产品在中国的管理法规,以及新产品研发上市需要知道 的注意事项。
会议时间
|
语言 |
日期 |
北京时间 |
演讲者 |
|
中文 |
2022年4月12日 |
9:00– 9:40 AM |
中国消毒抑菌产品研发上市合规要点 王方 女士 瑞旭集团日化事业部消毒剂法规技术专家 |
|
9:40-10:20AM |
中国驱蚊产品研发上市合规要点 丁平 女士 瑞旭集团农化事业部总经理 |
主办方
- 杭州瑞旭科技集团有限公司(CIRS)
会议软件
- 小鹅通
会议费用
- 免费

相关推荐:
- 电商平台消毒产品入驻要求分析
- 区分化妆品和消毒产品-勿将消毒产品当作化妆品进行销售宣传
- 国家药监局发布关于1批次化妆品检出禁用原料的通告(2021年第54号)
- GB 38598-2020《消毒产品标签说明书通用要求》2021年12月1日实施
UC的服务:
